

分析 (1)由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式可知氢气的浓度变化等于甲醇的浓度变化量3倍为2.25mol/L,据此计算;先根据浓度变化计算平衡时各物质的浓度,CH3OH的体积分数等于甲醇的物质的量浓度与总物质的量浓度之比;根据升高温度平衡向吸热反应方向移动判断;
(2)平衡常数等于生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比值;升高温度,平衡逆向移动,平衡常数减小;
(3)要提高CO2的转化率,应使平衡向正反应方向移动,根据平衡移动原理结合选项判断;
(4)依据计算浓度商和该温度下的平衡常数比较分析判断反应进行方向;
(5)要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动.
解答 解:(1)由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式CO2(g)+3H2(g)?CH3OH(g)+H2O可知,氢气的浓度变化等于甲醇的浓度变化量为0.75mol/L×3=2.25mol/L,故v(H2)=$\frac{2.25mol/L}{10min}$=0.225mol/(L•mon);
开始时c(CO2)=1mol/L、c(H2)=3mol/L,平衡时c(CO2)=0.25mol/L,c(CH3OH)=c(H2O)=0.75mol/L,则c(H2)=3mol/L-0.75mol/L×3=0.75mol/L,CH3OH的体积分数等于甲醇的物质的量浓度与总物质的量浓度之比,所以甲醇的体积分数=$\frac{0.75mol/L}{(0.25+0.75+0.75+0.75)mol/L}$×100%=30%
根据图象知,升高温度,逆反应速率大于正反应速率,平衡向逆反应方向移动,则正反应是放热反应;
故答案为:0.225mol/(L•min);30%;放热;
(2)由(1)可知平衡时各组分的浓度c(CO2)=0.25mol/L,c(CH3OH)=c(H2O)=0.75mol/L,则c(H2)=3mol/L-0.75mol/L×3=0.75mol/L,所以k=$\frac{c(CH{\;}_{3}OH)•c(H{\;}_{2}O)}{c(CO{\;}_{2})•c{\;}^{3}(H{\;}_{2})}$=$\frac{0.75×0.75}{0.25×0.75{\;}^{3}}$=5.33,升高温度,平衡逆向移动,平衡常数减小,
故答案为:5.33;减小;
(3)A.在原容器中再充入1mol H2,平衡向正反应方向移动,CO2的转化率增大,故正确;
B.在原容器中再充入1molCO2CO2的转化率反而减小,故错误;
C.缩小容器的容积即增大压强,平衡向正反应方向移动,CO2的转化率增大,故正确;
D.使用更有效的催化剂,平衡不移动,CO2的转化率不变,故错误;
E.将水蒸气从体系中分离出,平衡向正反应方向移动,CO2的转化率增大,故正确;
故答案为:BD;
(4)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.5mol/L,浓度商Q=$\frac{0.5×0.5}{0.5×0.5{\;}^{3}}$=4<K=5.33,说明反应正向进行v正>v逆;
故答案为:>;
(5)要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动,
A.因正反应放热,升高温度平衡向逆反应方向移动,则n(CH3OH)/n(CO2)减小,故A错误;
B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误;
C.将H2O(g)从体系中分离,平衡向正反应方法移动,n(CH3OH)/n(CO2)增大,故C正确;
D.缩小容器容积,增大压强,平衡向正反应方向移动,则n(CH3OH)/n(CO2)增大,故D正确.
故答案为:CD.
点评 本题考查较为综合,涉及化学平衡计算以及平衡移动等问题,题目难度较大,注意根据图象计算各物质的平衡浓度为解答该题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 按图装置进行试验时,观察到电流指针发生偏转,B池中C2极区溶液变红,回答下列问题(C,C1,C2均为石墨电极)
按图装置进行试验时,观察到电流指针发生偏转,B池中C2极区溶液变红,回答下列问题(C,C1,C2均为石墨电极)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子,G不是稀有气体元素.请回答下列问题:
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子,G不是稀有气体元素.请回答下列问题: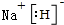 ;ZX与水反应放出气体的化学方程式为2NaH+H2O=2NaOH+H2↑.
;ZX与水反应放出气体的化学方程式为2NaH+H2O=2NaOH+H2↑. Fe+2ZG,放电时,电池的正极反应式为Fe2++2e-=Fe,该电池的电解质为β-Al2O3.
Fe+2ZG,放电时,电池的正极反应式为Fe2++2e-=Fe,该电池的电解质为β-Al2O3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | U原子核中含有92个中子 | B. | U原子核外有143个电子 | ||
| C. | 23592U和23892U互为同位素 | D. | 23592U和23892U互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | Mg条插入NaOH溶液中 | 有气泡产生 | Mg可以和NaOH溶液反应 |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰无紫色 | 原溶液中无K+ |
| C | 用玻璃棒蘸取氨水点到红色石蕊试纸上 | 试纸变蓝色 | 氨水呈碱性 |
| D | CO2通入CaCl2水溶液中 | 溶液变浑浊 | 生成CaCO3沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe2+、NO3-、SO42- | B. | Al3+、NO3-、SO42-、AlO2- | ||
| C. | OH-、HCO3-、Cl-、K+ | D. | Fe3+、K+、SCN-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二种 | B. | 三种 | C. | 四种 | D. | 五种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 豆浆中加入石膏做豆腐 | |
| B. | 在河流入海口处易形成三角洲 | |
| C. | 在FeCl3溶液中滴加NaOH溶液出现红褐色沉淀 | |
| D. | 清晨的阳光穿过茂密的林木枝叶产生美丽的光线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com