
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
分析 根据N=nNA可知,物质的量相等时含有的分子数相等,先分别计算出各物质的物质的量,根据计算结果进行判断.
解答 解:根据N=nNA可知,物质中所含的分子数相等,说明物质的物质的量相等,
①0.1mol CO2;
②9.8g H2SO4的物质的量为:$\frac{9.8g}{98g/mol}$=0.1mol;
③1g H2O的物质的量为:$\frac{1g}{18g/mol}$=$\frac{1}{18}$mol;
④1.6g O2的物质的量为:$\frac{1.6g}{32g/mol}$=0.05mol;
根据计算可知,物质的量相等的为①②,则含有分子数相等的为①②,
故选A.
点评 本题考查了物质的量的简单计算,题目难度不大,明确物质的量与摩尔质量、阿伏伽德罗常数之间的关系即可解答,试题侧重基础知识的考查,有利于提高学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,1L0.3mol•L-1CH3COOH溶液和3L0.1 mol•L-1CH3COOH溶液中的H+数 | |
| B. | 纯水在25℃和80℃时的pH | |
| C. | 在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数 | |
| D. | 相同条件下,H2分别与Cl2、F2反应的反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
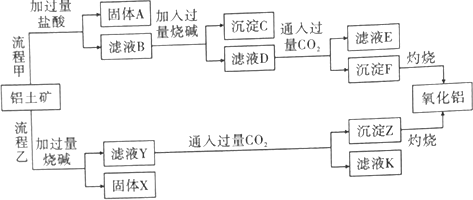
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
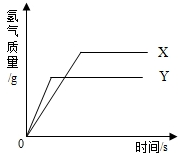 现有等质量的X、Y两种金属,分别放入溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如右图所示(已知X、Y在生成物中化合价均为+2价).则下列说法中不正确的是( )
现有等质量的X、Y两种金属,分别放入溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如右图所示(已知X、Y在生成物中化合价均为+2价).则下列说法中不正确的是( )| A. | 生成氢气的质量:X>Y | B. | 相对原子质量:X>Y | ||
| C. | 金属活动性:Y>X | D. | 消耗硫酸的质量:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 质量比为11:8 | B. | 原子个数之比为2:3 | ||
| C. | 物质的量之比为3:2 | D. | 密度之比为8:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com