
| A. | Ba (OH)2溶液与过量NaHCO3溶液混合离子方程式:Ba2++OH-+HCO3-═BaCO3↓+H2O | |
| B. | Na+的结构示意图: | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 氢氧化铁的电离方程式:Fe(OH)3═Fe3++3OH- |
分析 A.反应生成碳酸钡、碳酸钠和水;
B.钠的质子数为11;
C.原子核内有10个中子的氧原子,质量数为10+8=18;
D.氢氧化铁为弱电解质.
解答 解:A.Ba (OH)2溶液与过量NaHCO3溶液混合离子方程式的离子反应为Ba2++2OH-+2HCO3-═BaCO3↓+2H2O+CO32-,故A错误;
B.Na+核外存在10个电子核内有11个质子,其微粒结构示意图为: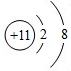 ,故B错误;
,故B错误;
C.原子核内有10个中子的氧原子为${\;}_{8}^{18}$O,故C正确;
D.氢氧化铁的电离方程式为Fe(OH)3?Fe3++3OH-,故D错误;
故选C.
点评 本题考查较综合,涉及离子方程式书写、结构示意图、原子表示方法及电离方程式等,为高频考点,把握化学用语的使用为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80mL 10mol/L的浓盐酸与足量的MnO2加热反应,产生Cl2分子数为0.2NA | |
| B. | 25g质量分数为68%的H2O2水溶液中含氧原子数目为NA | |
| C. | 1L 1mol/L的Fe2(SO4)3溶液中含有的SO42-离子数为3NA | |
| D. | 常温常压下,等质量的CO和N2中含有的原子数目均为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCN的结构式:H-C≡N | |
| B. | HClO的电子式: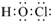 | |
| C. | 中子数为16的硫原子符号为:${\;}_{32}^{16}$S | |
| D. | Na+的离子结构示意图: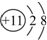 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3+HCl═NH4Cl | B. | 4NH3+5O2$\frac{\underline{\;Pt\;}}{△}$4NO+6H2O | ||
| C. | 3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O | D. | 8NH3+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$6NH4Cl+N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 X、Y、Z、M、Q是五种短周期主族元素,原子序数依次增大.X、Y可形成最常用溶剂;X、Y、Z最外层电子数之和为8;Y、M形成的气态化合物在标准状况下的密度为2.86g•L-1.请回答下列问题:
X、Y、Z、M、Q是五种短周期主族元素,原子序数依次增大.X、Y可形成最常用溶剂;X、Y、Z最外层电子数之和为8;Y、M形成的气态化合物在标准状况下的密度为2.86g•L-1.请回答下列问题: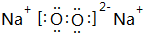 ;将A加入盛有酚酞试液的试管中观察到的现象为有大量气泡生成,溶液先变红后褪色,发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
;将A加入盛有酚酞试液的试管中观察到的现象为有大量气泡生成,溶液先变红后褪色,发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com