
【题目】A、B、C三种有机化合物,分子式都是C9H11O2N。
(1)化合物A是天然蛋白质的水解产物,光谱测定显示,分子结构中不存在甲基(—CH3)。化合物A的结构简式是____。
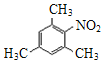
(2)化合物B是某种芳香烃与混酸在加热条件下进行硝化反应后的唯一产物。化合物B的结构简式是____。
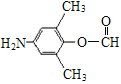
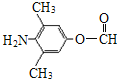
(3)化合物C能发生银镜反应、水解反应,且 氢核磁共振谱显示只有4组峰。化合物C的结构简式是__________。
【答案】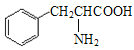
![]() 、
、 、
、
【解析】
(1)天然蛋白质的水解产物是α-氨基酸;
(2)化合物B是芳香烃硝化后只得到一种产物,结合硝化反应原理,可知芳香烃的分子式为C9H12,且芳香烃的结构对称,该芳香烃应为1,3,5-三甲基苯;
(3)化合物C能发生银镜反应说明含有醛基,能水解反应说明含有酯基,则一定含有HCOO-,结合氢核磁共振谱显示只有4组峰分析。
(1)A是天然蛋白质的水解产物,一定是一种α-氨基酸,光谱测定显示,分子结构中不存在甲基(-CH3),所以是含有苯环的结构,所以结构简式为: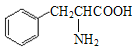 ;
;
(2)化合物B是芳香烃硝化后只得到一种产物,结合硝化反应原理,可知芳香烃的分子式为C9H12,且芳香烃的结构对称,该芳香烃应为1,3,5-三甲基苯,则化合物B的结构简式为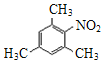 ;
;
(3)化合物C能发生银镜反应说明含有醛基,能水解反应说明含有酯基,则一定含有HCOO-,氢核磁共振谱显示只有4组峰,则可能结构中除HCOO-外,还含有2个甲基、一个-NH2,对应的结构简式为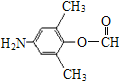 和
和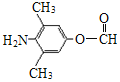 ;也可能还含有一个
;也可能还含有一个![]() ,对应的结构简式为
,对应的结构简式为![]() 。
。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示:

请你根据上图推断:
(1)原溶液中一定存在的阴离子有_______________,显___(填“酸”“碱”或“中”)性。
(2)实验③中产生无色无味气体所发生的化学方程式为__________________________________。
(3)写出实验④中A点对应沉淀的化学式:__________。
(4)写出实验④中,由A→B过程中所发生反应的离子方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据官能团的不同对下列有机物进行分类(填序号)。

(1)芳香烃:_____________ ;
(2)卤代烃:_____________;
(3)醇:_______________ ;
(4)酚:_____________;
(5)醛:_______________ ;
(6)酮:_____________;
(7)羧酸:_____________ ;
(8)酯:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧熔融碳酸盐燃料电池是一种高温电池(600﹣700℃),具有效率高、噪音低、无污染等优点。氢氧熔融碳酸盐燃料电池的工作原理如图所示。下列说法正确的是( )
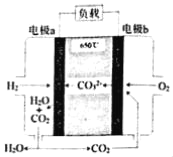
A.电池工作时,熔融碳酸盐只起到导电的作用
B.负极反应式为H2﹣2e﹣+CO32﹣═CO2+H2O
C.电子流向是:电极a﹣负载﹣电极b﹣熔融碳酸盐﹣电极a
D.电池工作时,外电路中流过0.2mol电子,消耗3.2gO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用粗盐水(溶质主要成分为NaCl),制备NaHCO3固体,流程如图:
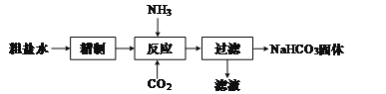
(1)“精制”是为了除去粗盐水中含有的Ca2+、Mg2+、SO![]() 等杂质离子,并获得NaCl饱和溶液,“精制”过程中包含除杂、过滤、蒸发浓缩等操作,需要加入的试剂为稍过量的①Na2CO3、②BaCl2、③盐酸、④NaOH,加入试剂的先后顺序为___(填序号)。
等杂质离子,并获得NaCl饱和溶液,“精制”过程中包含除杂、过滤、蒸发浓缩等操作,需要加入的试剂为稍过量的①Na2CO3、②BaCl2、③盐酸、④NaOH,加入试剂的先后顺序为___(填序号)。
(2)已知“反应”分两步进行。第一步生成NH4HCO3;
第二步的反应方程式为:NH4HCO3+NaCl=NaHCO3↓+NH4Cl。
①第一步反应的化学方程式为___。
②第二步反应能发生的原因是___。
(3)向“过滤”所得滤液中加入NaCl,并通入氨气,过滤,得到固体,该固体可能含有NaCl和NH4Cl,检验该固体中含有NH4Cl的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钠—过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:
①准确称取1.7700g样品,配制成100.00mL溶液A。
②准确量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825g。
③准确量取25.00mL溶液A,加适量稀硫酸酸化后,用0.02000mol·L—1KMnO4溶液至终点,消耗KMnO4溶液25.00mL。H2O2与KMnO4反应的离子方程式如下:
2MnO4— + 5H2O2 + 6H+ =2Mn2+ + 8H2O +5O2↑。
通过计算确定样品的组成(写出必要的计算过程)。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是海带中提取碘的流程图:
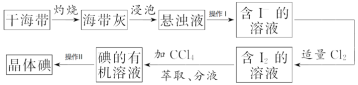
回答下列问题。
(1)干海带在_____________________中灼烧(填仪器名称)
(2)操作I名称为_____________________
(3)分液漏斗在使用前须清洗干净并_____________________,在本实验分离过程中,碘的四氯化碳应该从分液漏斗的_____________________(填“上口倒出”或“下口放出”)
(4)操作II名称为_____________________,该操作中加入碎瓷片的作用是_____________________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_____________________(填标号)。
A.立即补加B.冷却后补加C.不需补加D.重新配料
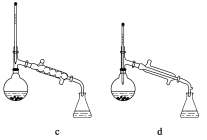
(5)在操作II中,仪器选择及安装都最合理的是_____________________(填标号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N元素的单质及其化合物之间的转化关系:NH3N2NO NO2HNO3。回答下列问题:
(1)N元素在元素周期表中的位置为_______;
(2)上述四种气体只能用排水法收集的是_______(填化学式,下同),只能用排空气法收集的是______;
(3)氮的氧化物是空气的主要污染物,下列环境问题与氮的氧化物排放有关的是_____;
A. 酸雨 B. 光化学烟雾 C. 白色污染 D. 臭氧层空洞
(4)NO2形成酸雨的化学方程式为______;
(5)Ertl(获2007年诺贝尔化学奖)对合成氨机理进行深入研究,并将研究成果用于汽车尾气处理中,在催化剂存在下可将NO和CO反应转化为两种无色无毒气体,用化学反应方程式表示这个过程______;
(6)若将12.8 g铜与 50 mL一定浓度的浓硝酸反应,两者恰好完全反应共产生气体5.6 L(标准状况),计算此浓硝酸的物质的量浓度_______(写出解题过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素,它们在周期表中的位置如图所示。下列推断正确的是( )

A. 原子半径:Z>Y>X
B. 元素非金属性:Z>Y>X
C. 最高价氧化物对应水化物的酸性:Z>Y>W
D. WH4与Z元素的单质在光照时发生置换反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com