
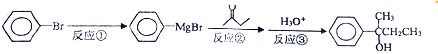
分析 根据题中各物质的转化关系可知,本实验是将溴苯先与镁反应(反应①)生成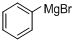 ,
, 与丁酮反应(反应②)生成
与丁酮反应(反应②)生成 ,
, 再与酸反应(反应③)生成
再与酸反应(反应③)生成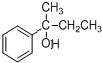 .
.
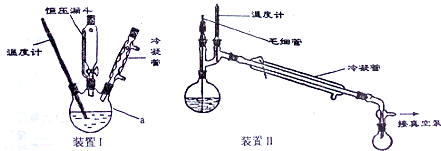
(1)根据图示仪器a为三颈烧瓶;
(2)反应①是用溴苯与镁条反应,用碘作催化剂;无水CaCl2具有吸水作用;
(3)装置Ⅰ中滴加液体用恒压漏斗,便于液体流下,反应②是放热反应,为防止反应过于剧烈,需将三颈烧瓶置于冰水中,且逐滴加入丁酮和乙醚;
(4)根据分液的基本步骤答题;
(5)减压蒸馏主要是防止温度过高物质发生分解,根据压蒸馏的操作要求答题;
(6)根据溴苯的质量计算2-苯基-2-丁醇的理论产量,产量=(实际产量÷理论产量)×100%.
解答 解:(1)仪器a有三个颈的烧瓶,名称叫三颈烧瓶,
故答案为:三颈烧瓶;
(2)反应①是用溴苯与镁条反应,用碘作催化剂,无水CaCl2具有吸水作用步骤3中加入适量无水CaCl2起干燥作用,
故答案为:催化剂;干燥作用;
(3)装置Ⅰ中滴加液体用恒压漏斗,便于液体滴加,反应②是放热反应,为防止反应过于剧烈,需将三颈烧瓶置于冰水中,且逐滴加入丁酮和乙醚,
故答案为:便于液体滴加;该反应放热,防止反应过于剧烈;
(4)步骤三中分离出油层,用分液操作即可,具体实验操作为:将混合液置于分液漏斗中,先放出下层液体于烧杯中,再将上层液体从上口倒入另一烧杯中,
故答案为:将混合液置于分液漏斗中,先放出下层液体于烧杯中,再将上层液体从上口倒入另一烧杯中;
(5)减压蒸馏时需将吸滤瓶与抽气泵相连,减压蒸馏主要是降低2-苯基-2-丁醇的沸点,防止温度过高发生分解,
故答案为:降低2-苯基-2-丁醇的沸点,防止温度过高发生分解;
(6)40mL溴苯(p=1.5g/cm3)质量为:m=ρv=60g,36.0mL2-苯基-2-丁醇(p=1.0g/cm3)质量为:m=ρv=36g
溴苯完全反应生成2-苯基-2-丁醇的理论产量为60g×$\frac{157}{150}$=62.8g,故2-苯基-2-丁醇的产率为$\frac{36g}{62.8g}$×100%≈57.3%,
故答案为:57.3%.
点评 本题考查有机物制备实验,涉及对装置及操作的分析评价、物质的分离提纯、产率计算等,注意操作规范性及仪器作用,理解实验原理是解题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | S既作氧化剂又作还原剂 | B. | 消耗12gC时,反应转移5mol电子 | ||
| C. | 还原产物只有K2S | D. | KNO3只发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 序号 | 实验步骤 | 预期现象 | 结论 |
| 1 | |||
| 2 | 锥形瓶中液体含大量Br- | ||
| 3 | 锥形瓶中液体含大量H+ |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 状态 | 密度/g•cm3 | 沸点/℃熔点/℃ |
| 乙醇 无色液体 | 0.79 | 78.5/-130 |
| 1,2-二溴乙烷 无色液体 | 2.2 | 132/9 |
| 乙醚 无色液体 | 0.71 | 34.6/-116 |
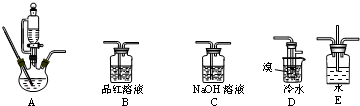
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
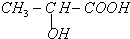 ,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 鸡蛋白溶液中分别滴入饱和硫酸铵和醋酸铅溶液 | 均有固体析出 | 均发生变性 |
| B | 溴水中分别加入苯酚和环己烯 | 溴水均褪色 | 均发生加成反应 |
| C | 某无色气体通入溴水中 | 溴水褪色 | 该气体一定是C2H4 |
| D | 适量水玻璃加入稀盐酸中, 振荡得透明溶液,用激光笔照射 | 有丁达尔效应 | 有硅酸胶体生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖、麦芽糖互为同分异构体 | |
| B. | 常用蛋白质的颜色反应来鉴别部分蛋白质 | |
| C. | 用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 | |
| D. | 油脂在酸性或碱性条件下均能发生水解反应,且产物不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com