
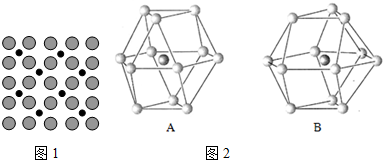
| N |
| Fe |
| N |
| Fe |


 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
| A、Ag+ NO3- Cl- H+ |
| B、Ba2+ SO42- NO3- Na+ |
| C、Ba2+ Mg2+ NO3- Cl- |
| D、CO32- H+ OH- Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴水中有下列平衡:Br2+H2O?HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 |
| B、对2HI(g)?H2(g)+I2(g),平衡体系增大压强可使颜色变深 |
| C、反应CO+NO2?CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动 |
| D、合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施(N2(g)+3H2(g)?2NH3(g);△H<0) |
查看答案和解析>>
科目:高中化学 来源: 题型:
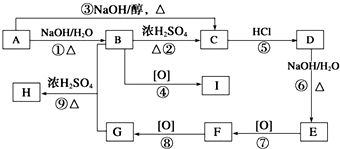
查看答案和解析>>
科目:高中化学 来源: 题型:
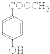 )出发,可发生图示的一系列反应,图中化合物D能使FeCl3溶液显紫色,G能进行银镜反应.E和H常温下为气体.试回答:
)出发,可发生图示的一系列反应,图中化合物D能使FeCl3溶液显紫色,G能进行银镜反应.E和H常温下为气体.试回答: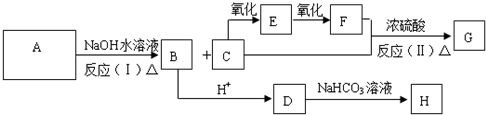
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
| B、0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA |
| C、标准状况下,22.4 L Cl2溶于足量NaOH溶液中,转移的电子数目为0.2NA |
| D、1 L 0.1 mol?L-1的Fe2(SO4)3溶液中,Fe3+的数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com