
| A. | NH4+、Ba2+、HCO3-、Cl- | B. | K+、Al3+、S2-、ClO- | ||
| C. | Na+、Fe3+、Cl-、SO42- | D. | NH4+、Mg2+、SO42-、NO3- |
分析 能与Al粉反应放出H2的溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,
A.铵根离子、碳酸氢根离子与氢氧根离子反应,碳酸氢根离子与氢离子反应;
B.次氯酸根离子能够氧化硫离子,铝离子与硫离子发生双水解反应;
C.酸性溶液中,四种离子之间不反应,都不与氢离子反应;
D.碱性溶液中,铵根离子、镁离子与氢氧根离子反应,硝酸根离子在酸性条件下具有强氧化性,加入铝不会生成氢气.
解答 解:能与Al粉反应放出H2,该溶液为酸性或碱性溶液,溶液中存在大量的H+或OH-,
A.HCO3-既能够与氢离子反应,也能够与氢氧根离子反应,且铵根离子与氢氧根离子反应,在溶液中一定不能大量共存,故A错误;
B.Al3+、S2-之间发生双水解反应,S2-、ClO-之间发生氧化还原反应,且Al3+与氢氧根离子反应,在溶液中一定不能大量共存,故B错误;
C.酸性溶液中,Na+、Fe3+、Cl-、SO42-离子之间不发生反应,且都不与氢离子反应,在溶液中能够大量共存,故C正确;
D.NH4+、Mg2+与氢氧根离子反应,NO3-在酸性条件下具有氧化性,加入铝后不会生成氢气,在溶液中一定不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:选择题
| A. | 硫的化学性质活泼,在自然界中只以化合态存在 | |
| B. | 硫是一种淡黄色能溶于水的固体 | |
| C. | 硫与金属或非金属反应均作氧化剂 | |
| D. | 1.6g硫与6.4g铜反应能得到8.0g纯净硫化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有的原子都含有质子、中子和电子三种基本构成微粒,且个数都是相等的 | |
| B. | 质子数决定元素的种类,中子数决定核素的种类 | |
| C. | 原子核对电子的吸引作用的实质是原子核中的质子对核外电子的吸引 | |
| D. | 原子中的质子、中子和电子三种基本微粒不可能进一步分成更小的微粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 单质、氧化物、酸、碱和盐的相互关系,可以用图简单表示,限选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转变用化学方程式表示(所写化学方程式不得重复).
单质、氧化物、酸、碱和盐的相互关系,可以用图简单表示,限选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转变用化学方程式表示(所写化学方程式不得重复).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质的物质的量/mol | 达到平衡时体系能量的变化/KJ | ||
| SO2 | O2 | SO3 | ||
| 甲 | 2 | 1 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 放出热量:Q2 |
| A. | 两容器中反应的平衡常数不相等 | |
| B. | 达到平衡时SO2的体积分数:甲<乙 | |
| C. | 197>Q1>Q2 | |
| D. | 生成1molSO3(l)时放出的热量等于98.5kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
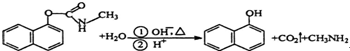
| A. | 西维因是一种芳香烃 | |
| B. | 西维因分子中所有碳原子一定共面 | |
| C. | 可用FeCl3溶液检验西维因是否发生水解 | |
| D. | 在Ni催化加热条件下西维因不能与H2加成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com