


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 |
| B.铵盐受热易分解 |
| C.0.1 mol·L-1氨水可以使酚酞试液变红 |
| D.0.1 mol·L-1氯化铵溶液的pH约为5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| pH | c(CrO42-) | c(HCrO4-) | c(Cr2O72-) | c(H2CrO4) |
| 4 | 0.0003 | 0.1040 | 0.4480 | 0 |
| 6 | 0.0319 | 0.0999 | 0.4370 | 0 |
| 7 | 0.2745 | 0.0860 | 0.3195 | 0 |
| 9 | 0.9960 | 0.0031 | 0.0004 | 0 |
| A.铬酸第一级电离方程式为H2CrO4?H++HCrO4- |
| B.要得到CrO42-应控制溶液的pH>9 |
| C.当电离达到平衡时,2v(正)(HCrO4-)=v(逆)(Cr2O72-) |
| D.该铬酸溶液的物质的量浓度约为1.00mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.加入少量NaOH固体,电离平衡向正向移动 |
| B.通入少量HCl气体,溶液的pH增大 |
| C.加入少量CH3COONa固体,电离平衡向正向移动 |
| D.加入NaCl溶液,电离平衡向正向移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液的pH值变小 |
| B.醋酸的电离度增大 |
| C.溶液的导电能力增强 |
| D.中和此溶液所需的0.1mol?L-1 NaOH溶液的体积增加 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
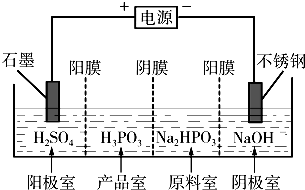
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.
| B.
| ||||||
C.
| D.
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊试液呈红色 | ||
| B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 | ||
| C.pH=2与pH=1的硝酸中c(H+)之比为10:1 | ||
D.向0.1mol/L的氨水中加入少量醋酸铵固体,则溶液中
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
| c(CH3COOH) |
| c(CH3COO-)c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com