
将密度为1.84 g / cm3、质量分数为98%的浓硫酸稀释成1 000 mL、物质的量浓度为2 mol /L、密度为1.20 g / cm3的稀硫酸。求:
(1)所需浓硫酸的体积;
(2)所需水的体积。
(1)108.7 mL (2)1000 mL
【解析】
试题分析:解:n(硫酸)=2 mol /L×1 L=2 mol
m(硫酸)=2 mol×98 g / mol=196 g
m(浓硫酸)=196 g÷98%=200 g
V(浓硫酸)=200 g÷1.84 g / cm3 =108.7 mL
m(稀硫酸)=1.20 g / cm3×1 000 mL=1 200 g
m(水)=1 200 g-200 g=1 000 g
V(水)=1 000 g÷1.00 g / cm3=1 000 mL
考点:物质的量以及物质的量浓度的相关计算
点评:该题是基础性试题的考查,但是该题给出的条件较多,信息量太多,这需要学生熟悉掌握相关的知识才能够较快解答此题。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源:2012-2013学年山西省曲沃中学高二下学期第一次月考化学试卷(带解析) 题型:计算题
将密度为1.84 g / cm3、质量分数为98%的浓硫酸稀释成1 000 mL、物质的量浓度为2 mol /L、密度为1.20 g / cm3的稀硫酸。求:
(1)所需浓硫酸的体积;
(2)所需水的体积。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年重庆市重庆一中高一10月月考化学试卷(带解析) 题型:实验题
(14分)I.实验室用Na2CO3·10H2O晶体配制50 g质量分数为21.2%的Na2CO3溶液。回答下列问题:
(1)应用托盘天平称取Na2CO3·10H2O晶体 g。
(2)用托盘天平和小烧杯称出碳酸钠晶体的质量,天平平衡后的状态如下图。由图中可以看出,该同学在操作时犯了一个错误是 。实际称量的碳酸钠晶体质量为 g。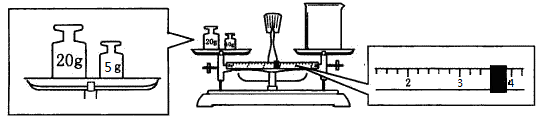
II. 实验室要配制2.5 mol/L 的稀硫酸溶液90 mL,回答下列问题:
(1)用量筒量取质量分数为98%,密度为1.84 g/cm3的浓硫酸 mL。
(2)配制时,必须使用的仪器除量筒、烧杯、玻璃棒外,还缺少的仪器是 。
(3)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是 。
| A.量取浓硫酸时,仰视读数 |
| B.洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中 |
| C.稀释硫酸时,有溶液溅到桌面上 |
| D.没有洗涤稀释硫酸的烧杯和玻璃棒 |
查看答案和解析>>
科目:高中化学 来源:江苏省2011届高三化学一轮过关测试(12) 题型:实验题
(11分)现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL、0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒②烧瓶③烧杯④胶头滴管⑤量筒?⑥容量瓶⑦托盘天平⑧药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有 (填代号)。
(2)经计算,需浓H2SO4的体积为 。现有①10 mL ②50 mL ③100 mL三种规格的量筒,你选用的量筒是
(3)将浓H2SO4加适量蒸馏水稀释后,冷却片刻,随后全部转移到 mL的容量瓶中,转移时应用玻璃棒 。转移完毕,用少量蒸馏水洗涤 2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度 处。改用
滴加蒸馏水到瓶颈刻度的地方,使溶液的 。振荡、摇匀后,装瓶、贴签。
(4)在配制过程中,其他操作都准确,下列操作中:错误的是 ,能引起误差偏高的有 (填代号)。
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
查看答案和解析>>
科目:高中化学 来源:2013届山西省高二3月月考化学试卷(解析版) 题型:实验题
实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr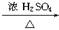 C2H5Br+H2O
C2H5Br+H2O
已知反应物的用量为:0.30 mol NaBr(s);0.25 mol C2H5OH(密度为0.80 g·cm-3);36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1);25 mL水。试回答下列问题。
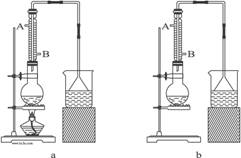
(1)该实验应选择图中的a装置还是b装置?_____________。
(2)反应装置中的烧瓶应选择下列哪种规格最合适( )
A.50 mL B.100 mL C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是 ( )
A. A进B出 B. B进A出 C. 从A进或B进均可
(4)可能发生的副反应为:_____________、__________、______________(至少写出3个方程式)。
(5)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是_______ _________。A、浓NaOH溶液 B、Na2SO3溶液 C、CCl4 D、水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com