
【题目】盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现据“三大酸”与金属铜反应的情况,回答下列问题:
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解,该反应的离子方程式为_。
(2)在一定体积的18mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol,则浓硫酸的实际体积__(填“大于”“等于”或“小于”)100mL。若使剩余的铜片继续溶解,可向其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为__。
(3)根据如图操作及现象推断酸X为__(填序号)。

A.浓盐酸 B.浓硫酸 C.浓硝酸
【答案】Cu+H2O2+2H+=Cu2++2H2O 大于 3Cu+8H++2NO![]() =3Cu2++2NO↑+4H2O B
=3Cu2++2NO↑+4H2O B
【解析】
(1)双氧水具有氧化性,在酸性环境下能将金属铜氧化溶解铜;
(2)铜只能和浓硫酸反应,同稀硫酸不反应,若使剩余的铜片继续溶解,可向其中加入硝酸盐,因溶液中有H+,再加入硝酸盐引入NO3-,相当于存在了硝酸,硝酸能将铜溶解;
(3)因浓硫酸和浓硝酸在常温下能使金属铁发生钝化,因最终向铁粉溶液中加入BaCl2会产生白色沉淀,故该溶液中含有SO42-,据此分析解答。
(1)双氧水具有氧化性,在酸性环境下能将金属铜氧化,方程式为:Cu+H2O2+2HCl=2H2O+CuCl2,离子反应为:Cu+H2O2+2H+=Cu2++2H2O;
(2)铜只能和浓硫酸反应,同稀硫酸不反应,Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,浓硫酸在反应中既显氧化性又显酸性,当被还原的硫酸是0.9mol,则18molL-1的浓硫酸的实际体积要大于100mL;若使剩余的铜片继续溶解,可向其中加入硝酸盐,因溶液中有H+,再加入硝酸盐引入NO3-,相当于存在了硝酸,硝酸能将铜溶解,反应实质为:3Cu+8H++2NO
CuSO4+SO2↑+2H2O,随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,浓硫酸在反应中既显氧化性又显酸性,当被还原的硫酸是0.9mol,则18molL-1的浓硫酸的实际体积要大于100mL;若使剩余的铜片继续溶解,可向其中加入硝酸盐,因溶液中有H+,再加入硝酸盐引入NO3-,相当于存在了硝酸,硝酸能将铜溶解,反应实质为:3Cu+8H++2NO![]() =3Cu2++2NO↑+4H2O;
=3Cu2++2NO↑+4H2O;
(3)因浓硫酸在常温下能使金属铁发生钝化,而稀硫酸能与铁发生反应,因最终向铁粉溶液中加入BaCl2会产生白色沉淀,故该溶液中含有SO42-,所以根据现象,可推断酸X为浓硫酸,答案选B。


科目:高中化学 来源: 题型:
【题目】钠、硫及其化合物用途非常广泛。回答下列问题:
(1)基态S原子价层电子的轨道表达式为________,基态Na原子电子占据最高能级的电子云轮廓图为________形。
(2)乙炔钠广泛用于有机合成,乙炔钠中存在________(填序号)。乙炔钠的熔沸点比S8高,原因是________。
A.金属键 B.σ键 C.π键 D.氢键
(3)NaN3是用于汽车安全气囊的产气药,N3—的空间构型为________,N3—中心原子的杂化方式是____________________。
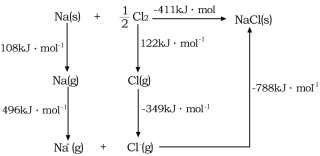
(4)![]() 的晶格能可通过图示中的born—Haber循环计算得到,Na原子的电子电离能为________kJ·mol-1,Cl-Cl的键能为_______kJ·mol-1,Cl的电子亲和能为_______kJ·mol-1,NaCl的晶格能为________kJ·mol-1。
的晶格能可通过图示中的born—Haber循环计算得到,Na原子的电子电离能为________kJ·mol-1,Cl-Cl的键能为_______kJ·mol-1,Cl的电子亲和能为_______kJ·mol-1,NaCl的晶格能为________kJ·mol-1。
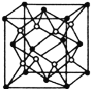
(5)已知![]() 的晶胞结构如图所示,晶体密度为1.86g·cm-3。设NA为阿伏加德罗常数的数值,则晶胞参数a=________
的晶胞结构如图所示,晶体密度为1.86g·cm-3。设NA为阿伏加德罗常数的数值,则晶胞参数a=________![]() (列出计算式)。
(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切联系。下列物质用途不正确的是( )
A.Fe2(SO4)3具有氧化性,可对饮用水杀菌消毒
B.Fe2O3为红色粉末,可用于制备红色涂料
C.Cu2O为红色粉末,可用于制备深色玻璃
D.CuSO4和熟石灰可配制农药﹣波尔多液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极下列叙述不正确的是( )

A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是O2+4OH--4e-=2H2O
C.电池总反应方程式为2H2+O2=2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器(内含物质)组装成实验装置:

(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
接 , 接 , 接 ;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?
乙中 ____ ,丙中 ______ ;
(3)丁中酸性KMnO4溶液的作用是 ;
(4)写出甲中反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/LKMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在______(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会______(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为_______________________________。
(4)计算H2C2O4溶液的物质的量浓度为__________mol/L。
II.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1molL-1KMnO4溶液 | 0.11molL-1H2C2O4溶液 | 0.11molL-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中v1=______。
(6)实验中需要测量的数据是______________________________。
(7)实验中______(填“能”或“不能”)用0.2mol/L盐酸代替0.1mol/LH2SO4溶液,理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是第四“常见”的金属,仅次于铁、铝及铜,在现代工业中对于电池的制造有不可磨灭的贡献,下列是以硫化锌精矿为原料制备单质锌的工业流程。
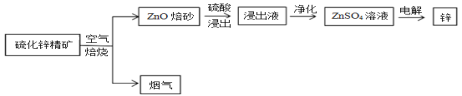
Ⅰ.(1)浸出液以硫酸锌为主,还含有 Fe3+、Fe2+、A13+、Cl-等杂质,会影响锌的电解,必须除去。净化过程如下:
①在酸性条件下,用H2O2将Fe2+氧化成Fe3+,离子方程式为___。
②将浸出液的pH调节为5.5左右,使 Fe3+、A13+形成沉淀而除去,可选用的最佳试剂为___(填字母)
A.NaOH B.NH3·H2O C.Zn(OH)2 D.H2SO4
③用Ag2SO4可除去Cl-,发生反应的离子方程式为______。
④电解过程中析出锌的电极反应式为___。
Ⅱ.烟气中的SO2可与软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的悬浊液反应制备MnSO4·H2O。
(2)已知:Ksp[Al(OH)3] =1×10-33,Ksp[Fe(OH)3] =3×10-39,pH =7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(欲使其浓度小于1×10-6mol·L-1),需调节溶液pH范围为___。
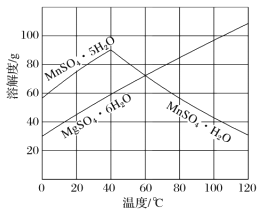
(3)由图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为___。
(4)锌锰碱性电池的总反应式为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,正极反应式为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:
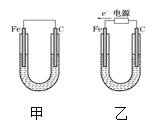
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的___棒,乙装置中的____棒;
②乙装置的电化学防护法称为____,其中碳极的电极反应式是:_____。
③取少量甲装置中负极附近溶液加入2滴K3[Fe(CN)6]溶液,现象为___,发生反应的离子方程式为________
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:______。
②甲装置碳极的电极反应属于_____(填“氧化反应”或“还原反应”);
③将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因_____
(3)用铂作电极电解饱和的下列物质的水溶液,一会儿后,向剩余电解液中加适量水,能使溶液和电解前相同的是(_____)
A.KI B.H2SO4 C.CuCl2 D.AgNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com