
| A. | 以甲基橙为指示剂滴至溶液由红色变橙色 | |
| B. | 滴定前碱式滴定管尖嘴处有气泡,滴定后气泡消失 | |
| C. | 滴定管读数时,滴定前仰视,终点时俯视 | |
| D. | 振荡时锥形瓶中的液滴溅出来 |
分析 该中和滴定中c(待测)=$\frac{c(标准).V(标准)}{V(待测)}$,如果标准溶液浓度、标准溶液体积偏大或待测溶液体积偏小,会导致测定浓度偏高;如果标准溶液浓度、标准溶液体积偏小或待测溶液体积偏大,会导致测定浓度偏低,据此分析解答.
解答 解:A.甲基橙变色范围为3.1-4.4,以甲基橙为指示剂滴至溶液由红色变橙色,溶液变色时溶液呈酸性,使用的NaOH溶液体积偏小,则测定结果偏低,故A错误;
B.滴定前碱式滴定管尖嘴处有气泡,滴定后气泡消失,使用的NaOH溶液体积偏大,则测定结果偏高,故B正确;
C.滴定管读数时,滴定前仰视,终点时俯视,导致使用的NaOH体积偏小,则测定结果偏低,故C错误;
D.振荡时锥形瓶中的液滴溅出来,导致待测溶液体积偏小,使用的NaOH体积偏小,则测定结果偏低,故D错误;
故选B.
点评 本题以酸碱滴定为载体考查误差分析,为高频考点,明确滴定中和反应原理及产生误差原因是解本题关键,侧重考查学生实验操作、实验分析评价能力,易错选项是C.


科目:高中化学 来源: 题型:解答题
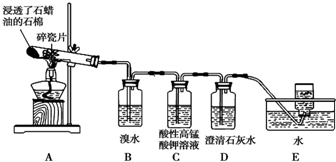
 用1-丁醇、溴化钠和较浓H2SO4混合物为原料,在实验室制备1-溴丁烷,并检验反应的部分副产物.(已知:NaCl+H2SO4(浓)=NaHSO4+HCl↑)现设计如下装置,其中夹持仪器、加热仪器及冷却水管没有画出.请回答下列问题:
用1-丁醇、溴化钠和较浓H2SO4混合物为原料,在实验室制备1-溴丁烷,并检验反应的部分副产物.(已知:NaCl+H2SO4(浓)=NaHSO4+HCl↑)现设计如下装置,其中夹持仪器、加热仪器及冷却水管没有画出.请回答下列问题:| 物质 | 熔点/0C | 沸点/0C |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

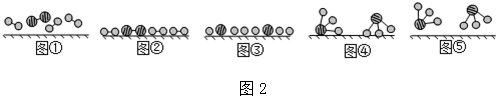
 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锥形瓶用蒸馏水洗涤后,直接盛盐酸溶液 | |
| B. | 中和滴定将要达到滴定终点时,眼睛注视滴定管中液面的位置变化 | |
| C. | 滴定管装碱液前未用标准碱液润洗 | |
| D. | 滴定时,锥形瓶摇动太剧烈,有少量溶液溅出 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 工业合成氨时采用铁触媒作反应的催化剂 | |
| C. | 工业生产硫酸的过程中使用过量的空气以提高SO2的转化率 | |
| D. | 将收集NO2气体的烧瓶密闭后放在装有热水的烧杯中,发生颜色变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com