
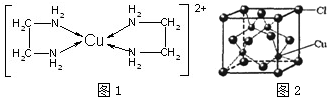
分析 (1)根据核外电子排布规律书写Cu原子的核外电子排布式,电子按能层高低进行失去,进而书写Cu2+的外围电子排布式;
同周期自左而右,电负性增大,据此判断O、N元素的电负性,H元素与O、N元素化合时,表现正化合价,H元素的电负性比O、N元素小;
(2)SO2分子的中心原子S原子的杂化轨道数为3,采取sp2杂化,含有1对孤对电子对,为V型结构;
(3)乙二胺(H2N-CH2-CH2-NH2)中N原子呈3个σ键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化;
乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,但三甲胺[N(CH3)3]分子之间不能形成氢键;
(4)由图1可知配离子[Cu(En)2]2+的配位数为4,离子中存在配位键、C-N键、C-H键、N-H键、C-C键,据此判断离子化学键类型;
(5)由CuCl的晶胞结构图可知,每个Cu+周围有4个Cl-,故每个Cl-周围有4个Cu+.
解答 解:(1)Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,故Cu2+的外围电子排布式为3d9;
同周期自左而右,电负性增大,电负性O>N,H元素与O、N元素化合时,H元素表现正化合价,H元素的电负性比O、N元素小,故电负性O>N>H;
故答案为:3d9;O>N>H;
(2)SO2分子的中心原子S原子的杂化轨道数为$\frac{6}{2}$=3,采取sp2杂化,含有1对孤对电子对,故SO2为V型结构;
故答案为:V型;
(3)乙二胺(H2N-CH2-CH2-NH2)中N原子呈3个σ键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化;
乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,故乙二胺的沸点较高;
故答案为:sp3杂化;乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键;
(4)由图1可知配离子[Cu(En)2]2+的配位数为4;
离子中存在配位键、C-N键、C-H键、N-H键、C-C键,其中C-N键、C-H键、N-H键为极性键,C-C键为非极性键,故离子含有配位键、极性键、非极性键,故选ABD;
故答案为:4;ABD;
(5)由CuCl的晶胞结构图可知,每个Cu+周围有4个Cl-,故每个Cl-周围有4个Cu+;故答案为:4.
点评 本题考查核外电子排布规律、电负性、杂化轨道、分子空间结构、氢键与化学键、晶胞等,综合性较大,难度中等,是对知识的综合运用,需要学生具备扎实的基础与分析问题解决问题的能力.


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:解答题


| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 酚醛树脂(phenolic resin)是人类合成的第一种高分子材料,至今仍被广泛使用.某校化学兴趣小组的同学通过下列方法在实验室制备酚醛树脂:
酚醛树脂(phenolic resin)是人类合成的第一种高分子材料,至今仍被广泛使用.某校化学兴趣小组的同学通过下列方法在实验室制备酚醛树脂: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在多电子的原子里,能量高的电子通常在离核近的区域内活动 | |
| B. | 核外电子只有排满了M层后才排N层 | |
| C. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| D. | 化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响.
地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽车尾气中有毒的NO和CO气体经充分反应后,理论上可完全转化为N2和CO2 | |
| B. | 使用高效催化剂可有效增大正反应速率 | |
| C. | 反应达到平衡后,NO的反应速率保持恒定 | |
| D. | 单位时间内CO和CO2减少的物质的量相等时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; _,反应类型是消去反应;
_,反应类型是消去反应; (其中任一种);(任写一种)
(其中任一种);(任写一种) .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com