
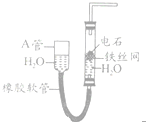
 如图中的实验装置可用于制取乙炔.请填空:
如图中的实验装置可用于制取乙炔.请填空:| 点燃 |


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
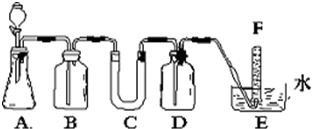
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | 除去CO2气体中混入的HCl 除去CO2气体中混入的HCl |
| C | 过氧化钠 过氧化钠 |
与CO2和水气反应,产生O2 与CO2和水气反应,产生O2 |
| D | NaOH溶液 NaOH溶液 |
吸收未反应的CO2气体 吸收未反应的CO2气体 |
查看答案和解析>>
科目:高中化学 来源:教材完全解读 苏教版课标版 高中化学 必修1 苏教版课标版 题型:058
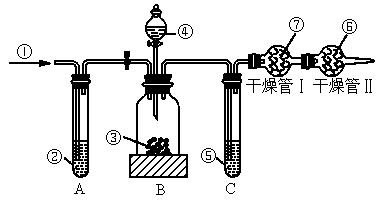
工业品纯碱中常含有少量的NaCl等杂质,图中的仪器装置可用来测定纯碱中Na2CO3的质量分数,图中标号:①空气,②某溶液,③纯碱样品,④稀H2SO4,⑤浓H2SO4,⑥碱石灰,⑦碱石灰.
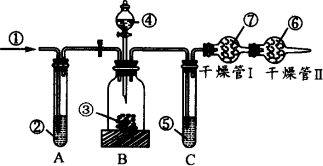
实验步骤是:
①检查装置的气密性;
②准确称量盛有碱石灰的干燥管Ⅰ的质量(设为m1 g);
③准确称量一定量的纯碱的质量(设为m2 g),并将其放入广口瓶中;
④从分液漏斗中缓缓滴入稀H2SO4,至不再产生气体为止;
⑤缓缓鼓入空气数分钟,然后称量干燥管Ⅰ的总质量(设为m3 g).
根据上述实验,回答下列问题:
(1)鼓入空气的目的是________.
(2)装置A中液体②应为________,其作用是________.如撤去装置A,直接向装置B中缓缓鼓入空气,测定结果将________.(填“偏大”、“偏小”或“不变”)
(3)装置C的作用是________,如果撤去装置C,则会导致实验结果________.(填“偏大”、“偏小”或“不变”)
(4)干燥管Ⅱ的作用是________.
(5)上述实验的操作④和⑤,都要求缓缓进行,其理由是________,如果这两步操作太快,则会导致实验测定结果________.(填“偏大”、“偏小”或“不变”)
(6)根据实验,纯碱中Na2CO3的质量分数的计算式为________.
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058
工业品纯碱中常含有少量的NaCl等杂质,图中的仪器装置可用来测定纯碱中![]() 的质量分数,图中标号:①空气,②某溶液,③纯碱样品,④稀
的质量分数,图中标号:①空气,②某溶液,③纯碱样品,④稀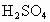 ,⑤浓
,⑤浓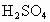 ,⑥碱石灰,⑦碱石灰.
,⑥碱石灰,⑦碱石灰.
实验步骤是:
①检查装置的气密性;
②准确称量盛有碱石灰干燥管Ⅰ的质量(设为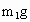 );
);
③准确称量一定量的纯碱的质量(设为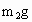 ),并将其放入广口瓶中;
),并将其放入广口瓶中;
④从分液漏斗中缓滴入稀![]() ,至不再产生气体为止;
,至不再产生气体为止;
⑤缓缓鼓入空气数分钟,然后称量干燥管Ⅰ的总质量(设为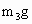 ).
).
根据上述实验,回答下列问题:
(1)鼓入空气的目的是___________________________________.
(2)装置A中液体②应为_________,其作用是__________,如撤去装置A,直接向装置B中缓缓鼓入空气,测定结果将_________(填“偏大”、“偏小”或“不变”).
(3)装置C的作用是_____,如果撤去装置C,则会导致实验结果________(填“偏大”、“偏小”或“不变”).
(4)干燥管Ⅱ的作用是____________________________________.
(5)上述实验的操作④和⑤,都要求缓缓进行,其理由是________,如果这两步操作太快,则会导致实验测定结果_______(填“偏大”、“偏小”或“不变”).
(6)根据实验,纯碱中![]() 的质量分数的计算式为__________.
的质量分数的计算式为__________.
查看答案和解析>>
科目:高中化学 来源: 题型:058
工业品纯碱中常含有少量的NaCl等杂质,图中的仪器装置可用来测定纯碱中![]() 的质量分数,图中标号:①空气,②某溶液,③纯碱样品,④稀
的质量分数,图中标号:①空气,②某溶液,③纯碱样品,④稀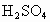 ,⑤浓
,⑤浓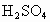 ,⑥碱石灰,⑦碱石灰.
,⑥碱石灰,⑦碱石灰.

实验步骤是:
①检查装置的气密性;
②准确称量盛有碱石灰干燥管Ⅰ的质量(设为 );
);
③准确称量一定量的纯碱的质量(设为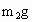 ),并将其放入广口瓶中;
),并将其放入广口瓶中;
④从分液漏斗中缓滴入稀![]() ,至不再产生气体为止;
,至不再产生气体为止;
⑤缓缓鼓入空气数分钟,然后称量干燥管Ⅰ的总质量(设为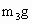 ).
).
根据上述实验,回答下列问题:
(1)鼓入空气的目的是___________________________________.
(2)装置A中液体②应为_________,其作用是__________,如撤去装置A,直接向装置B中缓缓鼓入空气,测定结果将_________(填“偏大”、“偏小”或“不变”).
(3)装置C的作用是_____,如果撤去装置C,则会导致实验结果________(填“偏大”、“偏小”或“不变”).
(4)干燥管Ⅱ的作用是____________________________________.
(5)上述实验的操作④和⑤,都要求缓缓进行,其理由是________,如果这两步操作太快,则会导致实验测定结果_______(填“偏大”、“偏小”或“不变”).
(6)根据实验,纯碱中![]() 的质量分数的计算式为__________.
的质量分数的计算式为__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
工业品纯碱中常含有少量的NaCl等杂质,下列图中的仪器装置可用来测定纯碱中的Na2CO3的质量分数,图中标号:① — 空气;② — 某溶液;③ — 纯碱样品;④ — 稀H2SO4;⑤ — 浓H2SO4;⑥ — 碱石灰;⑦ — 碱石灰。
实验步骤是:
①检查装置的气密性;
②准确称量装有碱石灰的干燥管I的质量(设为m1g);
③准确称量一定量的纯碱的质量(设为m2g),并将其放入广口瓶中;
④从分液漏斗中缓缓滴入稀H2SO4,至不再产生气体为止;
⑤缓缓鼓入空气数分钟,然后称量干燥管I的总质量(设为m3g)。
根据上述实验,回答下列问题:
(1)鼓入空气的目的是 。
(2)装置A中液体②应为 ,其作用是 ,如撤去装置中的A直接向装置B中缓缓鼓入空气,测定结果将 (填“偏大”、“ 偏小”或“ 不变”。)
(3)装置C的作用是 ,如果撤去装置C,则会导致实验结果 (填“偏大”、“ 偏小”或“ 不变”。)
(4)干燥管Ⅱ的作用是 。
(5)上述实验操作的④和⑤,都要求缓缓进行,其理由是 ,如果这两步操作太快则会导致实验结果 (填“偏大”、“ 偏小”或“ 不变”。)
(6)根据实验,纯碱中Na2CO3的质量分数计算式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com