
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
(1) 定性分析:如图甲可通过观察____________________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____________________________________________________________________,
写出H2O2在二氧化锰作用下发生反应的化学方程式
____________________________________________________________________。
(2) 定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是___________________________________________________________。
检查乙装置气密性的方法是
____________________________________________________________________。
(3) 0.6mol X气体和0.6mol Y气体混合于2 L密闭容器中,发生如下反应:
2X(g)+Y(g)===nZ(g)+2W(g), 2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的反应速率为0.1 mol/(L·min),则前2 min内,用X的物质的量浓度变化表示的平均反应速率为________;2 min末时Y的物质的量浓度为________;化学方程式中,Z的化学计量数n=________。
(4) 在一定温度下,反应:2A(s)+2B(g) C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是________
A.容器内的压强不随时间而变化
B.混合气的密度不再随时间而变化
C.A的质量不再改变
D.平衡混合气体的平均相对分子质量不再改变
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省上冈高级中学高二下学期期中考试化学试卷(带解析) 题型:填空题
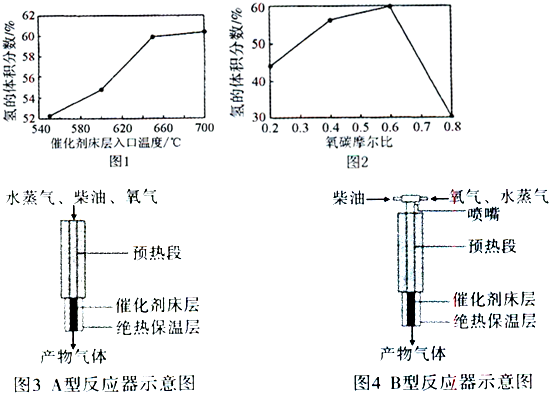
(16分)以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g)  CO(g)+H2(g) ΔH=+131.3 kJ?mol-1,
CO(g)+H2(g) ΔH=+131.3 kJ?mol-1,
①该反应在常温下 自发进行(填“能”与“不能”);
②恒温,在容积可变的密闭容器中,进行如上可逆反应。一段时间后,下列物理量不发生变化时,能表明该反应已达到平衡状态的有
Ⅰ混合气体的密度; Ⅱ容器内气体的压强;
Ⅲ混合气体的总物质的量; ⅣCO物质的量浓度
A.只有Ⅳ B.只有Ⅰ和Ⅳ C.只有Ⅱ和Ⅲ D.Ⅰ、Ⅲ和Ⅳ
(2)水煤气再进一步反应可制取氢气。反应为H2O(g)+CO(g) H2(g)+CO2(g),某温度下该反应的平衡常数K= 4/9。该温度下在甲、乙、丙三个恒容密闭容器中,只投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是 。
H2(g)+CO2(g),某温度下该反应的平衡常数K= 4/9。该温度下在甲、乙、丙三个恒容密闭容器中,只投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是 。
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
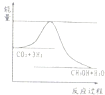
 CH3OH(g)+H2O(g) ,右图表示该反应进行过程中能量(单位为kJ?mol—1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2反应
CH3OH(g)+H2O(g) ,右图表示该反应进行过程中能量(单位为kJ?mol—1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2反应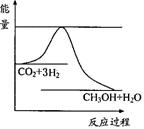
查看答案和解析>>
科目:高中化学 来源:2012学年四川省高一下学期期中考试化学试卷(解析版) 题型:实验题
(10分)经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
(1) 定性分析:如图甲可通过观察____________________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____________________________________________________________________,
写出H2O2在二氧化锰作用下发生反应的化学方程式
____________________________________________________________________。

(2) 定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是___________________________________________________________。
检查乙装置气密性的方法是
____________________________________________________________________。
(3) 0.6 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,发生如下反应:
2X(g)+Y(g)===nZ(g)+2W(g), 2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的反应速率为0.1 mol/(L·min),则前2 min内,用X的物质的量浓度变化表示的平均反应速率为________;2 min末时Y的物质的量浓度为________;化学方程式中,Z的化学计量数n=________。
(4) 在一定温度下,反应:2A(s)+2B(g)  C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是________
C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是________
A.容器内的压强不随时间而变化
B.混合气的密度不再随时间而变化
C.A的质量不再改变
D.平衡混合气体的平均相对分子质量不再改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com