
【题目】T℃时,浓度均为1mol/L的两种弱酸HA、HB中不断加水稀释,并用pH传感器测定溶液pH。所得溶液pH的两倍(2pH)与溶液浓度的对数(lgc)的关系如图所示。下列叙述错误的是
已知:①HA的电离平衡常数:![]()
②pKa=-lgKa
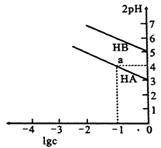
A. 酸性:HA>HB
B. a点对应的溶液中:c(HA)=0.1mol/L,c(H+)=0.01mol/L
C. T℃时,弱酸HB的pKa≈5
D. 弱酸的Ka随溶液浓度的降低而增大
科目:高中化学 来源: 题型:
【题目】亚砷酸(H3AsO3)可以用于治疗白血病,在溶液中存在多种微粒形态。向1L0.1mol·L-1H3AsO3溶液中逐滴加入KOH溶液,各种微粒物质的量分数与溶液的pH 关系如下图所示。下列说法正确的是( )
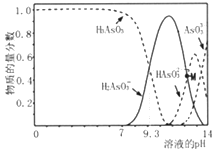
A. H3AsO3的电离常数Ka1的数量级为10-9
B. pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-=H2AsO3-+H2O
C. M点对应的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33-)+c(H3AsO3)=0.1mol·L-1
D. pH=12时,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如下所示化合物的说法不正确的是( )

A. 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B. 1mol该化合物最多可以与3molNaOH反应
C. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
D. 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.25 gmL﹣1、质量分数为36.5%的浓盐酸配制240 mL 0.1 molL﹣1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为________________________。
(2)配制240 mL 0.1 molL﹣1的盐酸
应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
__________ | __________ |
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)__________。
A.用30 mL水洗涤烧杯内壁和玻璃棒23次,洗涤液均注入容量瓶,振荡
B.用量筒淮确量取所需的浓盐酸的体积,倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线12 cm处
(4)若实验中遇到下列情况,对配制盐酸的物质的量浓度有何影响(填“偏高”“偏低”或“不变”)
①用于稀释盐酸的烧杯未洗涤__________________________________________;
②容量瓶中原有少量蒸馏水____________________________________________;
③定容时俯视观察液面________________________________________________。
(5)若实验过程中出现如下情况如何处理?
①定容时加蒸馏水时超过了刻度________________________________________;
②向容量瓶中转移溶液时不慎有溶液溅出________________________________;
③定容摇匀后发现液面下降____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】流动电池可以在电池外部调节电解质溶液,从而维持电池内部电解质溶液浓度稳定,原理如图。下列说法不正确的是
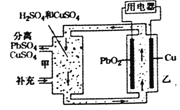
A. 甲中应补充硫酸
B. 当消耗1molPbO2时需分离出1molCuSO4
C. 电子由PbO2极流出经过用电器流向Cu极
D. 电池总反应为:Cu+PbO2+2H2SO4=CuSO4+PbSO4+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列对应的化学符号
(1)2个硝酸根离子__________
(2)铁锈的主要成分________ 熟石灰的化学式________
(3)硫原子的结构示意图__________硫化钠中硫元素的化合价________
(4)除去氯化钠溶液中的氢氧化钠和碳酸钠,可加入的试剂是________反应的化学方程式是_______________;________;
(5)实验室制取二氧化碳的化学方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用氯酸钾和二氧化锰制取氧气的反应方程式为:2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
回答下列问题:
(1)该反应中被氧化的元素名称为______,生成1mol![]() 时转移电子的数目是______。
时转移电子的数目是______。
(2)从反应后的固体混合物中分离出难溶于水的![]() 的具体实验操作步骤:______。
的具体实验操作步骤:______。
(3)分离出的![]() 可用于实验室制取
可用于实验室制取![]() ,化学方程式为:MnO2+4HCl(浓)
,化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,其离子方程式为____。
MnCl2+Cl2↑+2H2O,其离子方程式为____。
(4)若两个反应中转移的电子的物质的量相同,则生成的![]() 和
和![]() 在相同状况下的体积比为____。
在相同状况下的体积比为____。
(5)以上两个反应都用到![]() ,其作用分别是 ______、_________。
,其作用分别是 ______、_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.100molL-1的盐酸滴定10ml0.100molL-1的Na2CO3溶液.溶液pH值与加入盐酸的体积的关系如图所示,已知室温时饱和CO2的pH为3.9,0.05molL-1NaHCO3的pH约为8.3,下列说法不正确的是
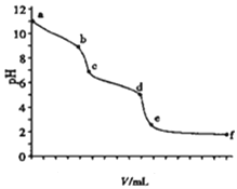
A. 以酚酞为指示剂,溶液颜色发生突变时(b点),Na2CO3转化为NaHCO3
B. 以甲基橙为指示剂,溶液颜色发生突变时,共消耗盐酸20.00ml
C. 溶液pH=7(c点),碳酸钠完全转化为NaCl
D. ce段对应溶液中CO2与NaHCO3共存
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com