
平衡是化学反应原理中的重要内容。按要求回答下列问题:
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH1 平衡常数为K1
2SO3(g) ΔH1 平衡常数为K1
2NO(g)+O2(g) 2NO2(g) ΔH2 平衡常数为K2
2NO2(g) ΔH2 平衡常数为K2
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=______ (用ΔH 1和ΔH 2表示);此反应该温度下的平衡常数K=______(用K1和K2表示)。
SO3(g)+NO(g)的ΔH=______ (用ΔH 1和ΔH 2表示);此反应该温度下的平衡常数K=______(用K1和K2表示)。
(2)已知A(g)+B(g)  C(g)+D(g),该反应在3L密闭容器中,在两种不同的条件下进行反应,A、B的起始物质的是分别为3.0mol和6.0mol,其中实验I的条件为T1℃。A的物质的量随时间的变化如图所示。
C(g)+D(g),该反应在3L密闭容器中,在两种不同的条件下进行反应,A、B的起始物质的是分别为3.0mol和6.0mol,其中实验I的条件为T1℃。A的物质的量随时间的变化如图所示。
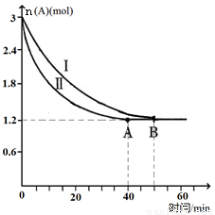
①实验Ⅱ可能改变的条件是_______________。
②T1℃时该反应的平衡常数为_____(用分数表 示),达到平衡时,A的反应速率为____。
(3)已知HCN溶液的电离平衡常数Ka=10-5 mol?L-1,c平衡(HCN)≈c起始(HCN),水的电离可不计,则此温度下0.1 mol?L-1的HCN溶液的pH=_________。
(4)对于0.1mol?L-1 Na2CO3溶液,该溶液中离子浓度由大到小的顺序是______,向该溶液中加水稀释的过程中,c(H2CO3)逐渐____(填“增大”“不变”或“减小”, 下同) ,c(H2CO3)/ c(CO32-)逐渐______。
(1) (ΔH1-ΔH2) /2 ;(K1/K2)1/2(只要表示方式正确均给分)
(2)①加压,加催化剂(2分,少一种扣1分,错一种倒扣1分);
②9/14(3分,有单位的扣1分);0.012 mol?L-1?min-1(单位错误或不写单位均扣1分。)
(3)3;
(4)c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)(;减小(1分),增大(1分)(没有按要求填写的不得分,如“增加”等)。
【解析】
试题分析:(1)第一个反应计量数同除以2,第二个反应的逆反应计量数同除以2,相加可得要求的反应,根据盖斯定律,?H=-1/2?H1—1/2?H2= (ΔH1-ΔH2) /2 ;分步反应加和,平衡常数为相乘,系数变化的倍数为指数,则K=(K1/K2)1/2
(2)①反应II反应速率加快,但平衡时A的物质的量不变,说明平衡不移动,因为该反应气体的系数不变,所以可能改变的条件是:加压,加催化剂
②根据“三段式”进行计算:A(g)+B(g)  C(g)+D(g)
C(g)+D(g)
初始浓度(mol?L?1) 1 2 0 0
初始浓度(mol?L?1) 0.6 0.6 0.6 0.6
初始浓度(mol?L?1) 0.4 1.4 0.6 0.6
平衡常数=0.6mol/L×0.6mol/L÷(0.4mol/L×1.4mol?L?1)= 9/14;
A的反应速率=0.6 mol/L÷40min=0.012 mol?L-1?min-1
(3)HCN的电离方程式为:HCN 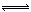 H++ CN-,因为水的电离可不计,所以H+浓度等于CN-浓度,则电离平衡常数K a=c2(H+)÷0.1mol?L?1=10-5 mol?L-1,解得c(H+)=10-3mol?L-1,pH=—lgc(H+)=3。
H++ CN-,因为水的电离可不计,所以H+浓度等于CN-浓度,则电离平衡常数K a=c2(H+)÷0.1mol?L?1=10-5 mol?L-1,解得c(H+)=10-3mol?L-1,pH=—lgc(H+)=3。
(4)Na2CO3为弱酸强碱盐,CO32?发生水解反应,第一步反应为:CO32?+H2O 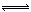 HCO3?+OH?,所以离子浓度由大到小的顺序是:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);向该溶液中加水稀释的过程中,溶液的体积逐渐变大,所以c(H2CO3)逐渐减小;加水稀释,水解平衡向右移动,所以c(H2CO3)/ c(CO32-)逐渐增大。
HCO3?+OH?,所以离子浓度由大到小的顺序是:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);向该溶液中加水稀释的过程中,溶液的体积逐渐变大,所以c(H2CO3)逐渐减小;加水稀释,水解平衡向右移动,所以c(H2CO3)/ c(CO32-)逐渐增大。
考点:本题考查焓变、平衡常数、反应速率、pH的计算,离子浓度比较。


科目:高中化学 来源:2013-2014学年广东省深圳市高三第二次调研考试理综化学试卷(解析版) 题型:填空题
香料Ⅴ的制备方法如下:

(1)化合物I的分子式为 ,Ⅳ中含氧官能团的名称是 。
(2)化合物I可由 经两步反应制得,写出第一步反应的化学方程式 。
经两步反应制得,写出第一步反应的化学方程式 。
(3)1mol的化合物II和Ⅲ分别与H2反应,最多消耗H2的物质的量之比为 。
(4)该工艺中第①步的目的是 。为检验①中CH3I的碘原子,实验室的操作是:取少量CH3I于试管中,加入足量的NaOH水溶液,加热充分反应,冷却后加入 ,再加入少量硝酸银溶液。
(5)芳香化合物Ⅵ是Ⅲ的一种无甲基同分异构体,能发生水解反应和银镜反应,Ⅵ的结构简式为 。
(6)一定条件下,化合物Ⅳ与乙二醇发生类似反应④的反应,该有机产物的结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省广州市毕业班综合测试(二)理综化学试卷(解析版) 题型:选择题
设nA为阿伏加德罗常数的数值,下列说法正确的是
A.1mol Cl2与过量的镁铁反应,转移2nA个电子
B.常温下,16g CH4含有8nA个电子
C.1L 0.5 mol·L-1Na2SO4溶液中含有nA个SO42-
D.常温常压下,22.4LCO2含有nA个CO2分子
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省枣庄市高三下学期第二次模拟考试理综化学试卷(解析版) 题型:填空题
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。请针对以下三种不同情况回答:
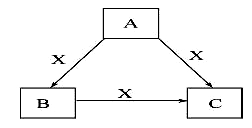
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素在元素周期表中的位置为__________,向水中加入X物质,X对水的电离平衡的影响是 (填“促进”、“抑制”或“无影响”) 。
②A与C的水溶液混合后生成B反应的离子方程式为 。
(2)若A为固态非金属单质,A与X同周期,同时A在X中燃烧,产生白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
①若A为该元素的白色固体单质,则1mol A单质中含共价键数目为 NA ,B的电子式为___________。
②X与水反应的离子方程式为 。
(3)若A、B、C的焰色反应呈黄色,水溶液均为碱性,常温下,X为气态酸性氧化物。
①A中所含有的化学键类型是_____________________。
②C溶液中离子浓度由小到大的顺序是__ _________________ 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省枣庄市高三下学期第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.Cl、Br、I的非金属性逐渐减弱,HCl、HBr、HI水溶液的酸性逐渐减弱
B.短周期元素形成离子后,最外层均达8电子稳定结构
C.多电子原子中,在离核较近的区域运动的电子能量较低
D.Cl、 S、P得电子能力和它们相应的最高价氧化物对应水化物的酸性均依次增强
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省文登市高三第三次统考理科综合化学试卷(解析版) 题型:选择题
下列与有机物的结构、性质有关的叙述正确的是
A.甲烷和氯气的反应与乙酸乙酯水解的反应属于同一类型的反应
B.蛋白质和油脂虽然都属于高分子化合物,但水解生成的产物不同
C.石油化工得到的产品均为液体,煤化工得到的产品有液体,也有固体
D.相同物质的量的乙烯和乙醇完全燃烧,乙醇消耗氧气的物质的量多于乙烯的
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三4月模拟考试(二模)理综化学试卷(解析版) 题型:填空题
研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别 占4%、l8%
I.(1)用于净化汽车尾气的反应为:2NO(g)+2CO(g)  2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
B.提高尾气净化效率的最佳途径是使用高效催化剂
C.增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率
D.提高尾气净化效率的常用方法是升高温度
(2)还可以用活性炭还原法处理氮氧化物,反应为:C(s)+2NO(g) N2(g)+CO2(g)
N2(g)+CO2(g)  H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.050 | 0.025 | 0.025 |
30 | 0.050 | 0.025 | 0.025 |
40 | 0.036 | 0.032 | 0.010 |
50 | 0.036 | 0.032 | 0.010 |
①T1℃时,该反应的平衡常数K= (保留两位小数)。
⑦前10min内用v(NO)表示的化学反应速率为 ,30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:l,则该反应的a 0(填“>”、“=”或“<”)。
Ⅱ.CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题。
(1)工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示

则用SO2除去CO的热化学方程式为 。
(2)高温时,也可以用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此反应的化学方程式是 。
②由Mg可制成“镁一次氯酸盐”电池,其装置示意图如图,则镁电极发生的电极反应式为 ,该电池总反应的离子方程式为 。

查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市高三年级4月考理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.阿司匹林是解热镇痛药,长期大量食用会有水杨酸反应,应停药并静脉注射NaHCO3溶液
B.食用一定量的油脂能促进人体对某些维生素的吸收
C.正常情况下,人体血液的pH总保持弱酸性范围,人体具有自动缓冲系统,能使血液的pH达到生理平衡
D.雾霾会引起呼吸道疾病
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市房山区高三一模理综化学试卷(解析版) 题型:选择题
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,其最外层电子数之和等于24,由此可知说法错误的是( )
W | X |
|
| Y | Z |
A.原子半径大小:W>X
B.元素最高正价:W>Z
C.简单阴离子的还原性:Y>Z
D.气态氢化物的稳定性:X>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com