
| A. | 合金中至少含有两种金属 | |
| B. | 漂白粉能在空气中长期存放 | |
| C. | 工艺师利用氢氟酸刻蚀石英制作艺术品 | |
| D. | NaOH溶液保存在配有磨口玻璃塞的细口试剂瓶中 |
分析 A.合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质;
B.漂白粉在空气中与二氧化碳反应生成次氯酸,次氯酸见光容易分解而导致变质;
C.二氧化硅能与氢氟酸反应生成四氟化硅气体;
D.玻璃中含有二氧化硅,二氧化硅能和强碱反应.
解答 解:A.合金中至少有一种金属,故A错误;
B.HClO虽是强氧化性的酸,但它是比碳酸还弱的酸,能与水和二氧化碳发生复分解反应,生成CaCO3和 HClO,故漂白粉不能长期在空气中放置,故B错误;
C.二氧化硅能与氢氟酸反应生成四氟化硅气体,可用于雕刻石英,故C正确;
D.玻璃中含有二氧化硅,二氧化硅能和氢氧化钠溶液反应生成具有粘性的硅酸钠,很容易将玻璃塞和玻璃瓶粘结在一起,所以氢氧化钠溶液应保存在配有橡胶塞的细口瓶中,故D错误.
故选C.
点评 本题考查合金、硅酸盐的性质、物质的保存,根据物质的性质确定物质的保存方法,题目难度不大,学习中注意相关基础知识的积累.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
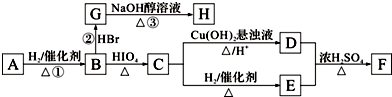
 .若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O.
.若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
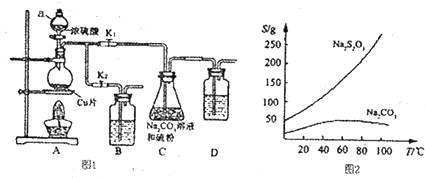
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

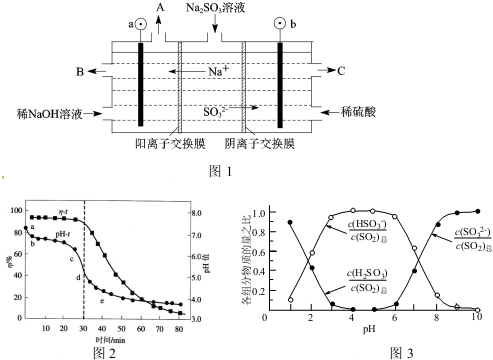
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液因不带电而稳定,胶体因带电而不稳定 | |
| B. | 定容时,因不慎使液面高于容量瓶的刻度线,需重新配制 | |
| C. | 用酒精可以从碘水中萃取碘 | |
| D. | 焰色反应是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电解结束后,阴极室溶液的pH与电解前相比将变大 | |
| B. | 若用铅蓄电池作该装置的供电电源,B接线柱应连接Pb | |
| C. | 涉及除去尿素的反应为CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl | |
| D. | 若通电一段时间后,电路中通过的电量是77.06×104C,则有8NA个H+通过质子交换膜 (一个电子所带的电量为1.6×10-19C) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提高臭氧浓度以改善空气质量 | B. | 提升矿物燃料的脱硫脱硝技术 | ||
| C. | 研发太阳能汽车代替燃油汽车 | D. | 开发不含氮、磷的洗涤清洁剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:2 | B. | 2:1:1 | C. | 1:2;1 | D. | 2:2;1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com