
分析 (1)碳酸根离子水解生成氢氧根离子溶液显碱性,设计实验有碳酸根离子时溶液显碱性,除去碳酸根离子后溶液不显碱性;
(2)碳酸钠属于强碱弱酸盐,碳酸根离子水解而使溶液呈碱性,根据其水解程度确定溶液pH,用pH试纸测量其pH即可;
(3)根据电荷守恒、物料守恒和质子守恒以及溶液中离子浓度大小比较的方法来分析;
(4)氢氧化钠为强碱溶液,氢氧根离子抑制了水的电离,溶液中氢离子是水电离的;碳酸钠溶液中,碳酸根离子水解促进了水的电离,溶液中氢氧根离子为水电离的,据此进行判断;
(5)在常温下如果要生成Cu(OH)2沉淀,应满足c(Cu2+)×c2(OH-)≥2×10-20,以此计算溶液的c(OH-),可确定溶液的pH.
解答 解:(1)碳酸根离子水解生成氢氧根离子溶液显碱性,其水解方程式为:CO32-+H2O?HCO3-+OH-,设计实验有碳酸根离子时溶液显碱性,除去碳酸根离子后溶液不显碱性,其操作为:取0.1mol/L的纯碱溶液少许于试管中,滴入几滴酚酞,溶液呈红色,再滴加足量BaCl2溶液或是氯化钡溶液,若溶液红色退去,则证明纯碱溶液显碱性的原因是CO32-水解;
故答案为:CO32-+H2O?HCO3-+OH-;BaCl2或CaCl2;
(2)常温下,0.1mol•L-1的纯碱溶液,发生水解的CO32-离子不超过其总量的10%,则溶液中c(OH-)>0.1mol/L×10%=0.01mol/L,则c(H+)<$\frac{1{0}^{-14}}{0.01}$mol/L=10-12mol/L,所以溶液的pH<12,用pH试纸测量常温下0.1mol/L碳酸钠溶液的pH,如果溶液的pH<12,则证明发生水解的CO32-离子不超过其总量的10%,
故答案为:用pH试纸测0.1mol/L的Na2CO3溶液的pH,pH<12;
(3)A.溶液中直接电离出钠离子和碳酸根离子,钠离子浓度大于碳酸根浓度的2倍,所以c(Na+)>2c(CO32-),故A正确;
B.在碳酸钠溶液中,碳酸根离子存在水解平衡,水存在微弱的电离,所以c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3),故B正确;
C.溶液中存在质子守恒:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故C正确;
D.根据物料守恒:c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1,故D错误;
E.溶液中存在电荷守恒:c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),故E错误.
故答案为:DE.
(4)25℃时,pH=13的碳酸钠溶液中,碳酸根离子水解促进了水的电离,溶液中氢氧根离子是水电离的,水电离的氢离子和氢氧根浓度均为:$\frac{1×1{0}^{-14}}{1×1{0}^{-13}}$mol/L=1×10-1mol/L;pH值等于13的NaOH溶液中,氢氧根离子抑制了水的电离,溶液中氢离子是水电离的,水电离的氢离子和氢氧根浓度均为:1×10-13mol/L,故Na2CO3和NaOH溶液中溶液中水电离产生的c(OH-)之比1012;
故答案为:1012;
(5)已知Ksp=2×10-20,c(Cu2+)=0.02mol•L-1,在常温下如果要生成Cu(OH)2沉淀,
则c(Cu2+)×c2(OH-)≥2×10-20,所以c(OH-)≥$\sqrt{\frac{2×1{0}^{-20}}{0.02}}$=10-9(mol/L),应调节溶液pH大于5,
故答案为:5.
点评 本题考查了盐类水解的原理、溶液酸碱性的实验测定方法、离子浓度大小比较、溶液中的守恒关系的应用、溶度积常数的有关计算等,题目涉及的知识点较多,题目难度中等,注意把握溶液中电荷守恒和物料守恒的应用,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 制 造 人 民 币 所 用 的 棉 花、优 质 针 叶 木 等 原 料 含 有 C、H、O 元 素 | |
| B. | 用 于 人 民 币 票 面 文 字 等 处 的 油 墨 中 所 含 有 的 Fe3 O4是 一 种 磁 性 物 质 | |
| C. | 防 伪 荧 光 油 墨 由 颜 料 与 树 脂 等 制 成,其 中 树 脂 属 于 有 机 高 分 子 材 料 | |
| D. | 某 种 验 钞 笔 中 含 有 碘 酒 溶 液,遇 假 钞 呈 现 蓝 色,其 中 遇 碘 变 蓝 的 是 葡 萄 糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第ⅠA族元素都是典型的金属元素 | |
| B. | 过渡元素都是金属元素 | |
| C. | 任何元素的原子都是由核外电子和核内质子、中子所组成 | |
| D. | 均属“镧系元素”的镧(57La)与铈(58Ce)互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
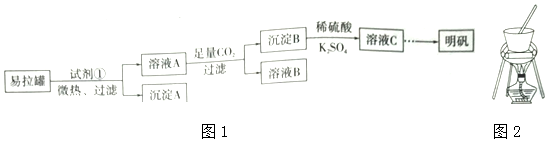
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.2g白磷中所含P-P键的数目为0.15NA | |
| B. | 含H2O2 3.4克的溶液完全分解,其电子转移数目为NA | |
| C. | 117g氯化钠固体含有2NA个氯化钠分子 | |
| D. | 6克金刚石含NA个C-C键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学创新实验小组设计如图示实验装置来制取溴苯并证明该反应为取代反应.已知:溴苯的熔点为?30.8℃,沸点156℃.
某化学创新实验小组设计如图示实验装置来制取溴苯并证明该反应为取代反应.已知:溴苯的熔点为?30.8℃,沸点156℃.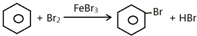 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温下向溶液中加入CaO,Ca2+离子数目减少 | |
| B. | 恒温下向溶液中加入CaO,溶液中C(Ca2+)减小 | |
| C. | 给溶液加热,溶液的pH不变 | |
| D. | 给溶液加热,溶液的离子浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,48gO3含有的氧原子数3NA | |
| B. | 33.6LCO中含有的原子数是3NA | |
| C. | 0.5mol•L-1CaCl2溶液中含Cl-数目为NA | |
| D. | 17gNH3所含的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发展清洁能源 | B. | 增加植被面积 | C. | 燃烧煤炭供热 | D. | 选择绿色出行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com