
【题目】将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的是
A. ①③⑤⑦⑧ B. ②④⑦ C. ①⑥ D. ②④⑥⑧
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定。
(1)岩脑砂的制备

①写出装置B中反应的化学方程式:_____________________________。
②装置C的仪器名称是_____________,装置F的作用是______________________。
③为了使氨气和氯(在D中充分混合,上述装置的合理连接顺序:_______→e f←_______(用小写字母和箭头表示,箭头方向与气流方向一致)。
④证明氨气和氯气反应有NH4Cl生成,需要的检验试剂中除了蒸馏水、稀硝酸、硝酸银溶液、红色石蕊试纸外,还需要_______________________。
(2)岩脑砂中元素的测定
准确称取ag岩脑砂,与足量的氧化铜混合加热
(发生的反应为:2NH4Cl+3CuO![]() 3Cu+N2↑+2HC1+3H2O),利用下列装置测定岩脑砂中氮元素和氯元素的物质的量之比。
3Cu+N2↑+2HC1+3H2O),利用下列装置测定岩脑砂中氮元素和氯元素的物质的量之比。

①装置H中盛装的试剂是_____________,其作用是_____________________。
②若装置I增重bg,利用装置K测得气体体积为V L(已知常温常压下气体摩尔体积为24.5L·mol-l),则岩脑砂中n(N)∶n(Cl)=_________(用含b、V 的代数式表示,不必化简)
③若取消J装置(其它装置均正确),n(N)∶n(Cl)比正常值________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于人造地球卫星的一种高能电池——银锌蓄电池,其电极式反应式为Zn+2OH--2e-======ZnO+H2O Ag2O+H2O+2e-======2Ag+2OH-。据此判断氧化银是
A. 负极,并被氧化 B. 正极,并被还原
C. 负极,并被还原 D. 正极,并被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】载人空间站为了循环利用人体呼出的CO2并将其转化为O2,设计装置工作原理如图所示,以实现“太阳能能→电能→化学能”的转化。总反应为2CO2=2CO+O2。下列说法正确的是
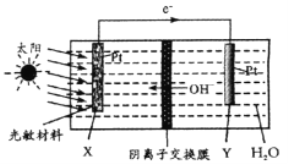
A. 该装置属于原电池 B. 水在Y电极参与反应
C. 反应完毕,该装置中电解质溶液碱性增强 D. X极反应:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
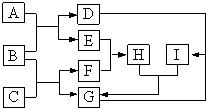
【题目】A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。
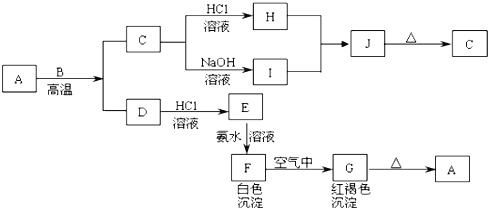
请回答下列问题
(1)写出下列物质的化学式A______,E_______,J________,G_______。
(2)F在空气中转化为G的化学方程式:______。
(3)C转化为I的离子方程式:______。
(4)H和I生成J的离子方程式:______。
(5)D在高温下和水蒸气反应的化学方程式:______。
(6)如何检验E中大量存在的阳离子?___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、MgCO3、Al2O3等杂质,工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:
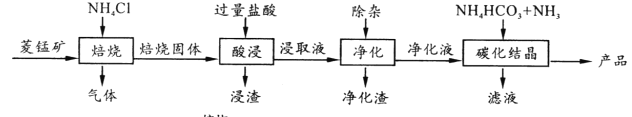
已知:MnCO3+2NH4Cl ![]() MnCl2+CO2↑+2NH3↑+H2O↑
MnCl2+CO2↑+2NH3↑+H2O↑
(1)焙烧时温度对锰浸取率的影响如图。
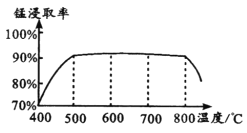
焙烧时适宜温度为_____;800℃以上锰的浸取率偏低,可能原因是________。
(2)净化包含三步: ①加入少量MnO2,反应的离子方程式为___;
②加氨水调pH,生成沉淀主要是_________;
③加入NH4F,除去Ca2+、Mg2+。
(3)碳化结晶中生成MnCO3的离子方程式为___________。
(4)滴定法测产品纯度
I 取固体产品1.160g于烧杯中,加入过量稀H2SO4充分振荡,再加入NaOH溶液至碱性,发生反应2Mn2++O2+4OH-=2MnO(OH)2;
II 加入过量KI溶液和适量稀H2SO4,发生反应:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
III 取I中混合液的1/10于锥形瓶中,加入淀粉溶液作指示剂,用0.1000mol/LNa2S2O3溶液进行滴定,发生反应:2S2O32-+I2=S4O62-+2I-,滴定终点时消耗Na2S2O3溶液20.00mL。
①判断滴定终点的方法是____________。
②假设杂质不参与反应,则产品纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液.下列说法正确的是( )
A. 电池工作时OH―向负极迁移 B. 正极反应式为2FeO42-+10H++6e―=Fe2O3+5H2O
C. 该电池放电过程中电解质溶液浓度不变 D. 电子由Zn电极流出,经KOH溶液流向正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质和条件已略去)。F是最简单的烃,B是最常见的无色液体,A是一种淡黄色固体,G是一种既能溶于强酸又能溶于强碱的白色固体,C由两种短周期元素组成,其摩尔质量为144g·mol1。
请问答下列问题:
(1)F的电子式为 。
(2)C的化学式为 。
(3)写出A与B反应的化学方程式: 。
(4)写出D溶液与G反应的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com