
| A、使用无磷洗衣粉是降低水体富营养化的方法之一 |
| B、海啸使水源发生污染用明矾进行净化和消毒 |
| C、SO2和NO2都能使雨水的pH<5.6造成酸雨 |
| D、合理开发和利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 |


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:

| A、长期暴露在空气中易变质 |
| B、既有酸性,又有碱性 |
| C、一定条件下能发生聚合反应 |
| D、分子中只有6个碳原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 |
| B、进行分液时,分液漏斗中的下层液体从下端流出,上层液体则从上口倒出 |
| C、萃取、分液前需对分液漏斗进行检漏 |
| D、将玻璃塞上的凹槽对准漏斗口颈上的小孔,可以保证分液漏斗内的液体顺利流出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ | B、①②③④ |
| C、①②④ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化合反应均为氧化还原反应,有单质生成的化学反应是氧化还原反应 |
| B、二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |
| C、溶液是电中性的,胶体是带电的 |
| D、电解质不一定导电,导电的物质不一定是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:

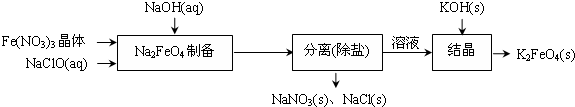
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com