
【题目】已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=﹣Q1 kJmol﹣1
2H2(g)+O2(g)═2H2O(g);△=﹣Q2 kJmol﹣1 ,
2H2(g)+O2(g)═2H2O(l);△H2=﹣Q3 kJmol﹣1
常温下,取体积比2:3的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为( )
A.0.4Q1+0.15Q2
B.0.2Q1+0.05Q2
C.0.2Q1+0.15Q3
D.0.2Q1+0.3Q2
【答案】C
【解析】标准状况下11.2L甲烷和氢气混合气体的物质的量为 ![]() =0.5mol,甲烷和氢气的体积之比为2:3,所以甲烷的物质的量为:0.5mol×
=0.5mol,甲烷和氢气的体积之比为2:3,所以甲烷的物质的量为:0.5mol× ![]() =0.2mol,氢气的物质的量为0.5mol﹣0.2mol=0.3mol,
=0.2mol,氢气的物质的量为0.5mol﹣0.2mol=0.3mol,
由CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=﹣Q1 kJmol﹣1 可知,0.2mol甲烷燃烧放出的热量为0.2mol×Q1 kJmol﹣1=0.2Q1 kJ,由2H2(g)+O2(g)═2H2O(l)△H3=﹣Q3kJmol﹣1可知,0.3mol氢气燃烧放出的热量为 ![]() ×Q3kJmol﹣1=0.15Q3kJ,所以放出的热量为0.2Q1kJ+0.15Q3kJ=(0.2Q1+0.15Q3)kJ,
×Q3kJmol﹣1=0.15Q3kJ,所以放出的热量为0.2Q1kJ+0.15Q3kJ=(0.2Q1+0.15Q3)kJ,
故答案为:C.
反应放出的总热量为各燃料放出的热量之和。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】根据所学知识,你认为下列叙述正确的是( )
A.同周期元素原子的最外层电子数相同
B.在周期表中,最外层电子数为1的元素都是金属元素
C.在周期表中,第18列元素的化学性质很稳定
D.ⅦA族元素容易失去电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒的物质的量分数δ随溶液pH的变化曲线如下图所示:下列说法正确的是:

A. 曲线1和曲线2分别表示8(H3PO4)和6(HPO42-)的变化
B. 25℃时,H3PO4的电离常数K1=10-2.1
C. pH=7.2时,溶液中c(H2PO4ˉ)+c(HPO42-)+c(OHˉ)=c(Na+)+c(H+)
D. pH=12.3时,溶液中由水电离出的c(H+)=10-12.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,十九大再次强调环境保护的重要性。“绿色化学”的核心是实现污染物“零排放”。下列符合 “绿色化学”理念的是
A. 甲烷与氯气制备一氯甲烷
B. 用稀硝酸和铜反应制取Cu(NO3)2
C. 由反应2SO2+02![]() 2SO3制SO3
2SO3制SO3
D. 向铜和稀硫酸的溶液中加入H2O2制备硫酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于水的电离平衡,下列叙述正确的是
A. 将水加热,pH不变
B. 向水中滴入稀醋酸,c(H+)增大
C. 恒温下,向水中加入少量硫酸,Kw增大
D. 向水中加入少量醋酸铵固体,水的电离程度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列方法制取氢气,反应速率最大的是( )
A.冬天,块状锌与2 molL﹣1硫酸溶液反应
B.冬天,粉末状锌与2 molL﹣1硫酸溶液反应
C.夏天,块状锌与2 molL﹣1硫酸溶液反应
D.夏天,粉末状锌与2molL﹣1硫酸溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示:
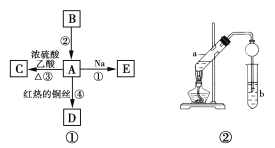
(1)写出B的结构简式__________,A中官能团的名称为__________。
(2)反应②和④的反应类型分别是__________、__________。
(3)写出下列反应的化学方程式:反应①__________,反应④__________。
(4)实验室利用反应③制取C,常用上图②装置:
①a试管中的主要化学反应的方程式为__________。
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是__________。
③试管b中液体作用是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)下列反应属于放热反应的是_______。
A.铝片与稀H2SO4反应制取H2 B.碳酸钙高温分解成氧化钙和二氧化碳
C.葡萄糖在人体内氧化分解 D.氢氧化钾和硫酸中和
E.Ba(OH)2·8H2O与NH4Cl固体反应
(2)一定条件下,SO2与O2反应5min后,若SO2和SO3物质的量浓度分别为1mol/L和3mol/L,则SO2起始物质的量浓度为______;用SO3表示这段时间该化学反应速率为_______。
(3)下图是某笔记本电脑使用的甲醇燃料电池的结构示意图。放电时甲醇应从____处通入(填“a”或b”),电池内部H+向_____(填“左”或“右”)移动。写出正极的电极反应式________。

(4)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
化学键 | H-H | N—H | N≡N |
键能kJ/mol | 436 | a | 945 |
已知:1molN2和3molH2反应生成2molNH3时放出热量93kJ,试根据表中所列键能数据计算a的数值_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com