
| A. | 煤油 | B. | 水 | C. | 酒精 | D. | 氯化钠溶液 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 明矾溶液中加入过量的氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 铜粉与98.3%的硫酸加热下反应 Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| C. | 氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| D. | 澄清石灰水中加入少量的NaHCO3溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
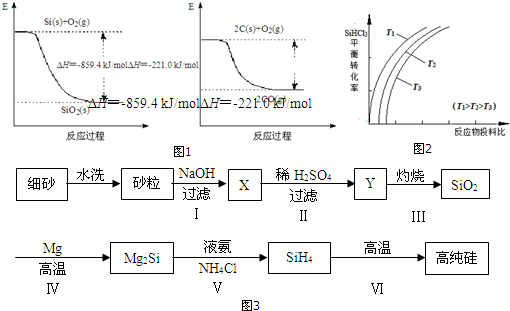
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答下列问题:
如图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$H2O+Cu | B. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | ||
| C. | Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O | D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2 800 | 2 050 | 714 | 191 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
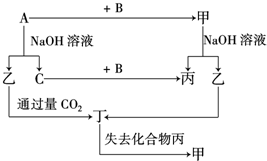 由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图所示的转换关系,已知C为密度最小的气体,甲是电解质.
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图所示的转换关系,已知C为密度最小的气体,甲是电解质.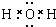 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com