
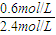 ×100%=25%,
×100%=25%,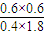 =0.5,
=0.5,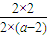 =0.5,解得a=6,
=0.5,解得a=6,

科目:高中化学 来源: 题型:
 (2011?湖南二模)(1)已知可逆反应:M(g)+N(g)
(2011?湖南二模)(1)已知可逆反应:M(g)+N(g) P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源:09~10年福州八县(市)高二下学期期末联考化学卷 题型:填空题
(8分)氯气及氯的化合物有着广泛的应用
(1)已知可逆反应Cl2+H2O HCl+HClO,向氯水中加入NaHCO3固体后,溶液中HClO的浓度 (填增大、减小、不变),原因是: 。
HCl+HClO,向氯水中加入NaHCO3固体后,溶液中HClO的浓度 (填增大、减小、不变),原因是: 。
(2)我国卫生部已明确提出:逐步用二氧化氯替代氯气进行饮用水的消毒。
①用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-)。卫生部规定,饮用水中ClO 2-的含量应不超过0.2mg·L-1。当pH≤2.0时, ClO2-能被I-还原成Cl-。请写出反应的离子方程式 。
2-的含量应不超过0.2mg·L-1。当pH≤2.0时, ClO2-能被I-还原成Cl-。请写出反应的离子方程式 。
②用ClO2处理过的自来水中会残留ClO2 ,可用FeCl2将ClO2还原为Cl-,该反应的氧化产物是 (填化学式)。现用V L(已换算为标准状况)ClO2处理一定量自来水,再加入a mol FeCl2可将残留的ClO2恰好除去。则该自来水中残留ClO2的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省芗城三校高三下学期第二次考试化学试卷(解析版) 题型:填空题
(共10分)
(1)已知可逆反应:M(g)+N(g) P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为_______________。
A.加入一定量M B.加入一定量N C.反应温度升高
D.缩小容器体积 E.加入某物质作催化剂 F.分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为_______________。此反应的化学平衡常数K=_______________。
③若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=_______________mol·L-1。
(2)随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求。
下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。甲醇在催化剂作用下提供质子和电子(电子转移的方向如下图所示),电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH+3O2===2CO2+4H2O。则c电极是 (填“正极”或“负极”),c电极上发生的电极反应式为_____________________________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com