
| A、NaOH溶液 |
| B、新制Cu(OH)2悬浊液 |
| C、石蕊试液 |
| D、Na2CO3溶液 |


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
| 原子 | N | S | O | Si |
| 半径 10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
| A、0.08×10-10m |
| B、1.10×10-10m |
| C、1.20×10-10m |
| D、0.70×10-10m |
查看答案和解析>>
科目:高中化学 来源: 题型:
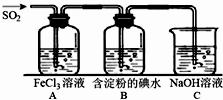
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、聚四氟乙烯分子中含有双键 |
| B、聚四氟乙烯的单体是不饱和烃 |
| C、聚四氟乙烯中氟的质量分数是76% |
| D、聚四氟乙烯的化学性质活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2和NO |
| B、O2和 NO2 |
| C、NO和 NO2 |
| D、NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | |
| 丙 | 丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com