
| A、Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) |
| B、Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) |
| C、Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) |
| D、CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) |


科目:高中化学 来源: 题型:
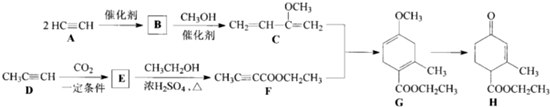
查看答案和解析>>
科目:高中化学 来源: 题型:
| 样品起始质量-a点固体质量 |
| 样品起始质量 |
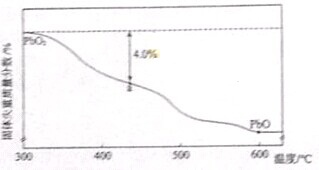
查看答案和解析>>
科目:高中化学 来源: 题型:
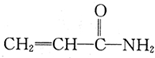 .下列相关分析正确的是( )
.下列相关分析正确的是( )| A、电负性:C<N<O |
| B、该分子中σ键与π键数目之比为4:2 |
| C、该分子所有原子处于同一平面 |
D、该分子的加聚产物为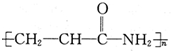 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) |
| B、Y分别与Z、W形成的化合物中化学键类型相同 |
| C、X的最高氧化物对应的水化物的酸性比W的弱 |
| D、Y的气态简单氢化物的热稳定性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定没有CO2,肯定有H2 |
| B、一定有CO、CO2和水蒸气? |
| C、一定有H2、CO2和HCl |
| D、可能有CO2、NH3和水蒸气? |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 |
| B、向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
| C、向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
| D、向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 |
| B、将NH4Cl溶液蒸干制备NH4Cl固体 |
| C、用萃取分液的方法除去酒精中的水 |
| D、用可见光束照射以区别溶液和胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com