
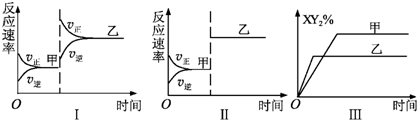
| A、图Ⅰ由甲至乙加入适当催化剂 |
| B、图Ⅱ由甲至乙扩大容器体积 |
| C、图Ⅲ由甲至乙增大压强 |
| D、图Ⅲ由甲至乙升高温度 |


科目:高中化学 来源: 题型:
| 选项 | 实验目的 | 实验设计 |
| A | 证明Ksp(AgCl)>Ksp(AgI) | 往AgCl悬浊液中滴入几滴KI溶液 |
| B | 除去Cu粉中混有的CuO | 向混合物中滴加适量稀硝酸 |
| C | 检验溶液中是否含有Fe2+ | 向溶液中滴入氯水后,再滴加KSCN溶液 |
| D | 证明H2CO3酸性比H2SiO3强 | Na2CO3和SiO2在高温下熔融反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3溶液的水解:CO32-+H3O+?HCO3-+H2O |
| B、AlCl3溶液中滴加浓氨水至过量:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| C、氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
| D、向NaHSO4溶液中加入过量Ba(OH)2溶液:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、NH4+、HCO3-、OH- |
| B、Fe3+、Zn2+、I-、SO42- |
| C、H+、K+、NO3-、SO42- |
| D、Ca2+、Na+、NO3-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol NH4+与1mol OH-所含的质子数均为10NA |
| B、标准状况下,22.4L CHCl3中含C-H键数目为NA |
| C、常温下,14g乙烯中含碳原子数为NA |
| D、常温下,pH=13的NaOH溶液中含OH-数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100 mL 1 mol?L-1的Na2CO3溶液中离子总数为0.3NA |
| B、若一筒120g的墨粉能打a个字,则平均每个字约含有10NA/a个碳原子 |
| C、在101kPa时,0.1NA个H2分子完全燃烧生成液态水,放出a kJ热量,表示氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H=+20akJ?mol-1 |
| D、常温下28g14CO含有14 NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=4的0.1 mol?L-1的NaHC2O4溶液中:c(HC2O4-)>c (H2C2O4)>c(C2O42-) |
| B、0.1 mol?L-1的NaHCO3溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C、常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
| D、常温下,等物质的量浓度的三种溶液:①(NH4)2SO4②NH4Cl ③(NH4)2Fe(SO4)2中c(NH4+):①<②<③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com