
| A. | 标准状况下,22.4 LH2O含有的分子数为NA | |
| B. | 1molAl3+离子含有的核外电子数为3NA | |
| C. | 3mol Fe在高温下与足量的水蒸汽反应转移的电子数为8NA | |
| D. | 1molNa2O2与足量的水反应失去电子数为2NA |
分析 A.标准状况下,水不是气体,不能带入n=$\frac{V}{{V}_{m}}$计算;
B.一个Al3+离子含有的核外电子数为10;
C.3Fe$\stackrel{-8e-}{→}$Fe3O4,3mol Fe含有原子数为3NA,失去电子数为8×$\frac{3{N}_{A}}{3}$N=8NA;
D.过氧化钠和水反应方程式为2Na2O2+2H2O=4NaOH+O2↑,该反应过氧化钠中O元素化合价由-1价变为-2价和0价.
解答 解:A.标准状况下,水不是气体,不能带入n=$\frac{V}{{V}_{m}}$计算,因此不能求算分子数,故A错误;
B.一个Al3+离子含有的核外电子数为10,1molAl3+离子含有的核外电子数为10NA,故B错误;
C.3Fe$\stackrel{-8e-}{→}$Fe3O4,3mol Fe含有原子数为3NA,失去电子数为8×$\frac{3{N}_{A}}{3}$N=8NA,故C正确;
D.过氧化钠中氧元素的化合价为-1价,1mol Na2O2与水完全反应生成0.5mol氧气,转移了1mol电子,转移电子数为1mol×NAmol-1=NA,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件以及转移电子数的计算方法.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
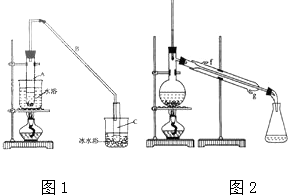 某化学小组以环己醇制备环己烯(如图1),
某化学小组以环己醇制备环己烯(如图1),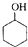 $→_{85℃}^{浓H_{2}SO_{4}}$
$→_{85℃}^{浓H_{2}SO_{4}}$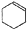 +H2O
+H2O| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去SO2中的少量HCl:通入饱和NaHSO3溶液的洗气瓶,干燥后收集气体 | |
| B. | FeCl2溶液中混有FeCl3:加入过量铁粉充分反应后过滤 | |
| C. | Na2CO3固体中混有少量NaHCO3:加入适量NaOH溶液 | |
| D. | 除去SiO2中的少量Al2O3:加入适量稀硫酸充分反应后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中有Cl- | |
| B. | 某溶液中先滴加足量盐酸无规象,再滴加BaCl2溶液有白色沉淀.则原溶液中有SO42- | |
| C. | 某无色溶液滴入酚酞试液显红色,该溶液一定是含有大量的H+ | |
| D. | 某溶液中滴加盐酸生成能使澄清石灰水变浑浊的无色气体,说明原溶液中有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应是放热还是吸热必须看生成物和反应物所具有的总能量的相对大小 | |
| B. | 绿色植物进行光合作用时,将太阳能转化为化学能储存起来 | |
| C. | 吸热反应都要加热才能进行 | |
| D. | 物质的化学能可以在一定条件下转化为热能、电能为人类所利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cu2+、Cl-、NO3- | B. | Na+、K+、SO32-、CO32- | ||
| C. | K+、HCO3-、NO3-、Cl- | D. | Ca2+、Mg2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
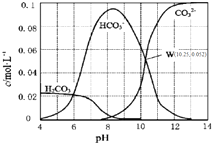 25℃时,0.1mol•L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如图所示.下列说法正确的是( )
25℃时,0.1mol•L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如图所示.下列说法正确的是( )| A. | 在pH=7.0时,溶液中含碳粒子只有CO32-和HCO3- | |
| B. | 向Na2CO3溶液中通入HCl气体,立即产生CO2气体 | |
| C. | H2CO3的Ka2=1.0×10-10.25 | |
| D. | 向100 mL 0.1 mol•L-1碳酸钠溶液中滴加盐酸至溶液pH=4.0,生成CO2气体224 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.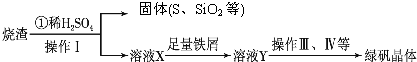
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
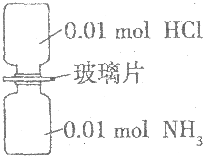 室温下,抽去如图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是(设NA表示阿伏加德罗常数的数值)( )
室温下,抽去如图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是(设NA表示阿伏加德罗常数的数值)( )| A. | 装置中氢元素的总质量为0.04g | |
| B. | 气体生成物的总体积为0.448 L | |
| C. | 生成物中含有0.01NA个分子 | |
| D. | 生成物完全溶于水后所得溶液含有0.01NA个NH4Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com