
分析 ①电子层越多,离子半径越大;具有相同电子排布的离子中,原子序数大的离子半径小;
②非金属性越强,对应氢化物越稳定;
③非金属性越强,对应阴离子的还原性越弱;
④非金属性越强,对应单质的氧化性越强;
⑤非金属性越强,对应最高价含氧酸的酸性越强;
⑥同周期从左向右非金属性增强,同主族从上到下非金属性减弱;
⑦同主族从上到下金属性增强,同周期从左向右金属性减弱;
⑧氨气含氢键沸点最高,氢化物中相对分子质量大的沸点高.
解答 解:①电子层越多,离子半径越大;具有相同电子排布的离子中,原子序数大的离子半径小,则r(S2-)>r(Cl-)>r(K+)>r(Al3+),故错误;
②非金属性越强,对应氢化物越稳定,则氢化物的稳定性:HF>HCl>H2S>PH3>SiH4,故正确;
③非金属性越强,对应阴离子的还原性越弱,则还原性:S2->I->Br->Cl-,故错误;
④非金属性越强,对应单质的氧化性越强,则氧化性:Cl2>S>Se>Te,故正确;
⑤非金属性越强,对应最高价含氧酸的酸性越强,碳酸与NaClO发生强酸制取弱酸的反应,可知酸性:H2SO4>H3PO4>H2CO3>HClO,故正确;
⑥同周期从左向右非金属性增强,同主族从上到下非金属性减弱,则非金属性:O>N>P>Si,故正确;
⑦同主族从上到下金属性增强,同周期从左向右金属性减弱,则金属性:Be<Mg<Ca<K,故正确;
⑧氨气含氢键沸点最高,氢化物中相对分子质量大的沸点高,则沸点:NH3>AsH3>PH3,故错误;
故答案为:①③⑧.
点评 本题考查元素周期律和周期表的应用,为高频考点,把握元素的位置、性质、元素周期律等为解答本题关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:选择题
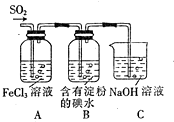
| A. | SO42-是SO2气体与Fe3+反应的还原产物 | |
| B. | 装置C烧杯中加入少量苯可以防止倒吸 | |
| C. | 表明I-的还原性弱于SO2的现象是B中溶液蓝色褪色 | |
| D. | 在A中的溶液加入KMnO4溶液,则紫红色褪去说明A中SO2与Fe3+发生了氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
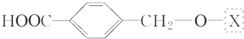 ,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.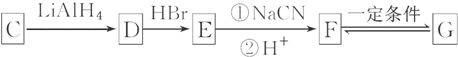
 .
. (其中两种).
(其中两种).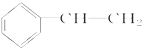 为主要原料制备
为主要原料制备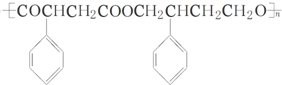
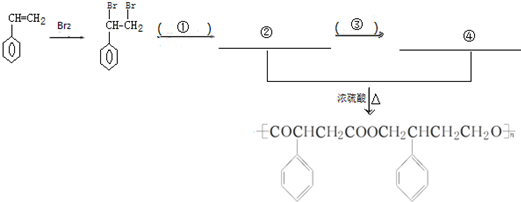
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
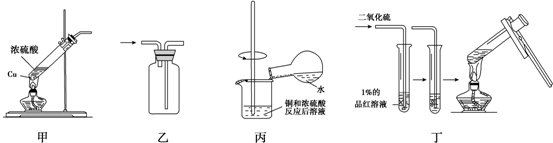
| A. | 用装置甲、乙制备和收集SO2 | |
| B. | 用装置甲、丙制备和稀释CuSO4溶液 | |
| C. | 用装置乙、丁收集和检验SO2的漂白性 | |
| D. | 用装置甲、丁制备和探究SO2的漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝是地壳里含量最多的金属元素 | B. | 铝容易失去电子,表现还原性 | ||
| C. | 在常温下,铝不能与氧气反应 | D. | 在空气中用酒精灯点不着 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
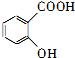
| A. | 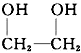 和HOOC-COOH 和HOOC-COOH | B. | HC≡CH | C. | 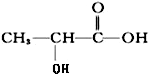 | D. | CH3COOH和C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
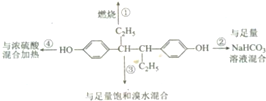 己烯雌酚是人工合成的非甾体雌激素物质,主要用于治疗雌激素低下症及激素平衡失调所引起的功能性出血等,如图所示分别取1 mol己烯雌酚进行4个实验.( )
己烯雌酚是人工合成的非甾体雌激素物质,主要用于治疗雌激素低下症及激素平衡失调所引起的功能性出血等,如图所示分别取1 mol己烯雌酚进行4个实验.( )| A. | ①中生成7molH2O | B. | ②中无CO2生成 | ||
| C. | ③中最多消耗3molBr2 | D. | ④中发生消去反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com