
| A. | 通过红外光谱分析可以区分乙醇和乙酸 | |
| B. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 | |
| C. | 光催化还原水制氢比电解水制氢更节能环保、更经济 | |
| D. | 石油的裂解、煤的干馏、蛋白质的盐析和淀粉的水解都是化学变化 |
分析 A.乙醇含-OH,乙酸含-COOH;
B.浓盐酸与氨气反应冒白烟;
C.光比电解消耗的能源少;
D.石油的裂解生成烯烃、煤的干馏生成煤焦油等、淀粉水解生成葡萄糖.
解答 解:A.红外光谱测定有机基团,可区别乙醇和乙酸,故A正确;
B.浓盐酸遇到浓氨水产生白烟,可检验氨气泄漏,故B正确;
C.光催化更环保经济,电解需耗费大量能源,故C正确;
D.蛋白质的盐析是物理变化不是化学变化,而石油的裂解、煤的干馏、淀粉的水解都是化学变化,故D错误;
故选D.
点评 本题考查物质的鉴别及检验,为高频考点,把握物质的性质、性质差异、发生的反应等为解答的关键,侧重分析与应用能力的考查,注意有机反应的判断,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol奥沙拉嗪( ) 与足量Na2CO3溶液反应能生成4molC O2B ) 与足量Na2CO3溶液反应能生成4molC O2B | |
| B. | 已知反应mX(g)+nY(g)?qZ(g),若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为1:1 | |
| C. | 1L 1mol/LNa2CO3溶液中含有3×6.02×1023个离子 | |
| D. | 在一定温度下,相同pH的硫酸和硫酸铁溶液中水电离出来的c(H+)分别是1.0×10-amol•L-1和是1.0×10-bmol•L-1,在此温度时,水的离子积为1.0×10-(b+a) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
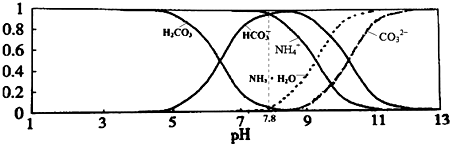
| A. | 当溶液的pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3•H2O)>c(CO32-) | |
| B. | NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3•H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3) | |
| C. | 由图可知,往该溶液中逐滴滴加氢氧化钠时NH4+浓度逐渐减小,HCO3-浓度先增大后减小 | |
| D. | 通过分析可知常温下:Ka1(H2CO3)>Kb(NH3•H2O)>Ka2(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol•L-1的氨水含有0.1 NA个OH- | |
| B. | 常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA | |
| C. | 80℃时,1L pH=1的硫酸溶液中,含有0.2NA个H+ | |
| D. | 在电解精炼粗铜的过程中,当阴极析出32g铜时转移电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、H+、NO3-、HCO3- | B. | K+、AlO2-、SO42-、NH3•H2O | ||
| C. | Na+、K+、SO32-、ClO- | D. | Na+、CH3COO-、SO42-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Na与乙醇完全反应,失去2NA电子 | |
| B. | 标准状况下,22.4L苯含NA个C6H6分子 | |
| C. | 0.5mol-OH和0.5mol OH-均含有5NA电子 | |
| D. | 常温常压,8gCH4含5NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com