
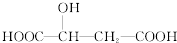 )说法正确的是( )
)说法正确的是( )| A、苹果酸不易溶于水而易溶于有机溶剂 |
| B、和苹果酸具有相同官能团的同分异构体只有1种 |
| C、1 mol苹果酸与足量NaOH溶液反应时,最多消耗3 mol NaOH |
| D、1mol苹果酸与足量NaHCO3溶液反应时,最多可得44.8LCO2(标准状况下) |


科目:高中化学 来源: 题型:
 某实验室制取苯甲酸的过程如下:
某实验室制取苯甲酸的过程如下: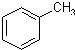 +2KMnO4
+2KMnO4| 反应Ⅰ |
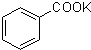 +MnO2+KOH+H2O
+MnO2+KOH+H2O| 温度/℃ | 4 | 18 | 75 |
| 溶解度/[g?(100gH2O)-1] | 0.18 | 0.27 | 2.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
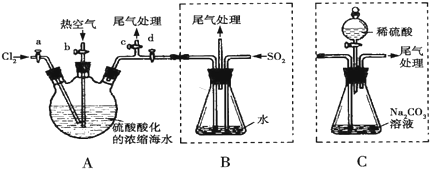
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
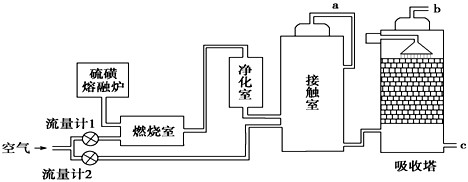
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定是共价键 |
| B、一定是离子键 |
| C、可能是共价键,也可能是离子键 |
| D、以上说法均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.96g |
| B、4.68g |
| C、2.15g |
| D、3.78g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com