
对相同状况下的12C18O和14N2两种气体,下列说法正确的是
A.若质量相等,则质子数相等
B.若原子数相等,则中子数相等
C.若分子数相等,则体积相等
D.若体积相等,则密度相等
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源:2016届湖北省沙市、沙市五中高考模拟理综化学试卷(解析版) 题型:简答题
氮、磷及其化合物在生产、生活中有重要的用途。回答下列问题:
I (1)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。
①写出磷酸主要的电离方程式________________________。
②直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnOx,x=_____(用n表示)。
(2)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式。
□H2PO2-+□Ag++□______=□PO43-+□Ag+□______
(3) 工业上生产硝酸铜晶体的流程图如下:
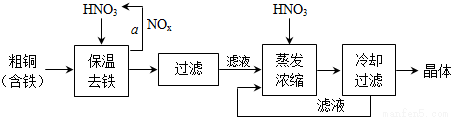
①在步骤a中,需要通入氧气和水,其目的是______.
②进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)______.
③下图是某小组同学查阅资料所绘出的硝酸铜晶体[Cu(NO3)2•nH2O]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是______(填字母).
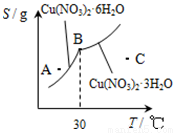
a.A点时的溶液为不饱和溶液
b.B点时两种晶体可以共存
c.按上述流程最终得到的晶体是Cu(NO3)2•3H2O
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2•6H2O晶体
II (4)查阅资料可知:银氨溶液中存在平衡:Ag+(aq)+2NH3(aq) Ag(NH3)2+(aq),该反应平衡常数的表达式K稳[Ag(NH3)2+]= _________,已知某温度下,K稳[Ag(NH3)2+]=1.10×107,Ksp[AgCl]=1.45×10﹣10。计算得到可逆反应AgCl(s)+2NH3(aq)
Ag(NH3)2+(aq),该反应平衡常数的表达式K稳[Ag(NH3)2+]= _________,已知某温度下,K稳[Ag(NH3)2+]=1.10×107,Ksp[AgCl]=1.45×10﹣10。计算得到可逆反应AgCl(s)+2NH3(aq) Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=_________ (保留2位有效数字),1L 1mol/L氨水中最多可以溶解AgCl_________mol(保留1位有效数字)。
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=_________ (保留2位有效数字),1L 1mol/L氨水中最多可以溶解AgCl_________mol(保留1位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:选择题
元素的性质随着元素原子序数的递增而而呈现周期性变化的原因是( )
A.元素原子的核外电子排布呈周期性变化
B.元素的原子半径呈周期性变化
C.元素的化合价呈周期性变化
D.元素的金属性、非金属性呈周期性变化
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二下期中理科化学试卷(解析版) 题型:选择题
下列叙述中正确的是( )
A.将KI和FeCl3溶液棍合,溶液变棕黄色,说明还原性Fe2+>I-
B.NO2通入FeSO4溶液中的过程中由浅绿色变为黄色
C.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
D.SO2通入BaCl2溶液中先有白色沉淀后沉淀溶解
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二下期中理科化学试卷(解析版) 题型:选择题
下列物质依次按照混合物、氧化物、弱电解质和非电解质的顺序排列的一组是( )
A.淀粉、CuO、HClO、Cu
B.水玻璃、Na2O•CaO•6SiO2、AgO、SO3
C.KAl(SO4)2•12H2O、KClO3、NH3•H2O、CH3CH2OH
D.普通玻璃、H2O、Fe(SCN)3、葡萄糖
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二下期中化学试卷(解析版) 题型:实验题
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的沸点见附表)。其实验步骤为:
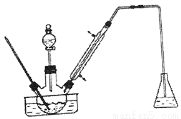
步骤1:将三颈瓶中的一定配比的无水AlCl3, 20mLl, 2 -二氯乙烷和20mL苯甲醛充分混合后.升温至60℃,缓慢滴加经H2SO4干燥过的液溴20mL,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,__________。
步骤3:有机相用10%NaHCO3溶液洗涤。经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。
(1)实验装置中冷凝管的主要作用是__________,锥形瓶中的溶液应为__________。
(2)步骤1所加入的物质中,AlCl3是催化剂,请推测1, 2-二氯乙烷的作用__________。
(3)有同学建议将装置中温度计换成搅拌器,那么温度计应移到什么地方__________。
(4)步骤2后续操作是__________。
(5)步骤3中用10%的NaHCO3溶液洗涤的具体操作是__________。加入无水MgSO4固体的作用是__________。
(6)步骤4中采用减压蒸馏技术,是为了防止__________。
(7)最后收集到间溴苯甲醛10mL,则该实验的产率为__________。
附表相关物质的沸点(101kPa)
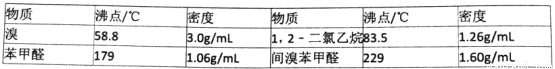
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二下期中化学试卷(解析版) 题型:选择题
如下a、b、c、d、e、f是六种有机物,其中a是烃类,其余是烃的衍生物,下列有关说法不正确的是
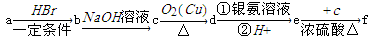
已知: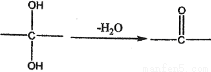
A.若a的相对分子质量是42,则d是丙醛
B.若d的相对分子质量是44,则a是乙炔
C.若a为苯乙烯(C6H5-CH=CH2),则f的分子式是C16H16O2
D.若a为单烯烃,则d与f的最简式一定相同
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏银川二中高二下期中化学试卷(解析版) 题型:填空题
有机物A可以通过不同的反应得到B和C:
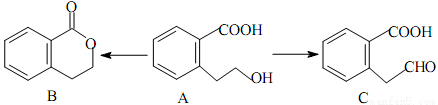
(1)A的分子式为_________________,C的含氧官能团名称为_________________。
(2)A制取C的有机反应类型为_________________;A制取B的化学方程式为:_________________。
(3)A发生消去反应后产物的结构简式为_________________,A分子中一定共面的碳原子有_________________个。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西吉安一中高二下第二次段考化学试卷(解析版) 题型:填空题
已知CO(g)+H2O(g) CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的△H__________0(填“<”“>”“=”);
(2)830℃时,向一个5L的密闭容器中充入0.20mol的CO和0.80mol的H2O,反应初始6s内CO的平均反应速率v(CO)=0.003mol•L-1•s-1,则6S末CO2的物质的量浓度为__________;反应经一段时间后,达到平衡后CO的转化率为__________;
(3)判断该反应是否达到平衡的依据为_______(填正确选项前的字母);
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(CO)不随时间改变 d.单位时间里生成CO和H2的物质的量相等
(4)已知1000℃时,要使CO的转化率超过90%,则起始物c(H2O):c(CO)应不低于__________;
(5)已知CO可用于制备很多物质:
2CO(g)+SO2(g)═S(g)+2CO2(g)△H=+8.0kJ•mol-1
2H2(g)+SO2(g)═S(g)+2H2O(g)△H=+90.4kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=-556.0kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
请写出S(g)与O2(g)反应生成SO2(g)热化学方程式_______________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com