
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2C2O4溶液:c(OH-)═c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)═2c(CO32-)+c(OH-) | |
| D. | CH3COONa和CaCl2溶液:c(Na+)+c(Ca2+)═c(CH3COO-)+c(OH-)+c(Cl-) |
分析 A.硫化钠溶液中,氢氧根离子来自水的电离和硫离子水解,则c(OH-)>c(HS-);
B.根据Na2C2O4溶液中的质子守恒判断;
C.根据碳酸钠溶液中的电荷守恒判断;
D.根据CH3COONa和CaCl2混合液中的电荷守恒判断.
解答 解:A.硫化钠溶液中,硫离子部分水解,溶液呈碱性,由于氢氧根离子还来自水的电离,则c(OH-)>c(HS-),溶液中正确的离子浓度大小为:c(Na+)>c(OH-)>c(HS-)>c(H2S),故A错误;
B.根据Na2C2O4溶液中的质子守恒可得:c(OH-)═c(H+)+c(HC2O4-)+2c(H2C2O4),故B正确;
C.根据碳酸钠溶液中的电荷守恒可知:c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(OH-),故C错误;
D.该混合液中存在电荷守恒:c(Na+)+2c(Ca2+)+c(H+)═c(CH3COO-)+c(OH-)+c(Cl-),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒及质子守恒的含义及应用方法,试题培养了学生的灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 用加热法除去NaOH固体中混有的NH4Cl固体. | |
| B. | 向Al2(SO4)3溶液中滴加过量的NaOH溶液制备Al(OH)3 | |
| C. | SO2能使酸性KMnO4溶液褪色,说明SO2具有漂白性 | |
| D. | 向水玻璃中滴加盐酸制备硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
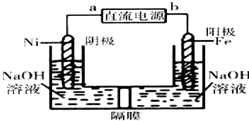 运用化学原理知识研究化学对于人类的生产生活、科研意义重大.
运用化学原理知识研究化学对于人类的生产生活、科研意义重大.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 氢氧燃料电池的负极反应式:O2+4H++4e-═2H2O | |
| C. | 粗铜精炼时,与电源正极相连是纯铜,电极反应式为Cu-2e-═Cu2+ | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
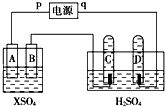 如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D极上均产生气泡,试回答:
如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D极上均产生气泡,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si→SiO2→H2SiO3→Na2SiO3 | B. | Al→Al2O3→Al(OH)3→NaAl(OH)4 | ||
| C. | N2→NH3→NO→NO2→HNO3→NO2 | D. | S→SO3→H2SO4→SO2→Na2SO3→Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
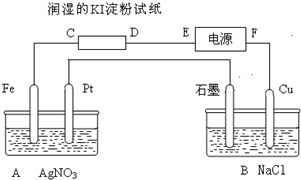 有电解装置如图所示.图中A装置盛1L 2mol/L AgNO3溶液.通电后,润湿的淀粉KI试纸的C端变蓝色,电解一段时间后试回答:
有电解装置如图所示.图中A装置盛1L 2mol/L AgNO3溶液.通电后,润湿的淀粉KI试纸的C端变蓝色,电解一段时间后试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com