
Ļņŗ¬ÓŠc(FeCl3)=0.2 mol”¤L-1”¢c(FeCl2)=0.1 mol”¤L-1µÄ»ģŗĻČÜŅŗÖŠµĪ¼ÓĻ”NaOHČÜŅŗ£¬æɵƵ½Ņ»ÖÖŗŚÉ«·ÖÉ¢Ļµ£¬ĘäÖŠ·ÖÉ¢ÖŹĮ£×ÓŹĒÖ±¾¶Ō¼ĪŖ9.3 nmµÄ½šŹōŃõ»ÆĪļ£¬ĻĀĮŠÓŠ¹ŲĖµ·ØÖŠÕżČ·µÄŹĒ
A£®øĆ·ÖÉ¢ĻµµÄ·ÖÉ¢ÖŹĪŖFe2O3
B£®ŌŚµē³”×÷ÓĆĻĀ£¬Ņõ¼«ø½½ü·ÖÉ¢ĻµŗŚÉ«±äÉī£¬ŌņĖµĆ÷øĆ·ÖÉ¢Ļµ“ųÕżµēŗÉ
C£®æÉÓĆ¹żĀĖµÄ·½·Ø½«ŗŚÉ«½šŹōŃõ»ÆĪļÓėNa+·ÖĄėæŖ
D£®¼ÓČėNaOHŹ±·¢ÉśµÄ·“Ó¦æÉÄÜĪŖ£ŗFe2++2Fe3++8OH-=Fe3O4+4H2O
 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
 ŹµŃéŹŅÖŠÓŠŅ»Ī“ÖŖÅØ¶ČµÄĻ”ŃĪĖį£¬Ä³Ń§ÉśĪŖ²ā¶ØŃĪĖįµÄÅضČŌŚŹµŃéŹŅÖŠ½ųŠŠČēĻĀŹµŃ飮ĒėÄćĶź³ÉĻĀĮŠĢīæÕ£ŗ
ŹµŃéŹŅÖŠÓŠŅ»Ī“ÖŖÅØ¶ČµÄĻ”ŃĪĖį£¬Ä³Ń§ÉśĪŖ²ā¶ØŃĪĖįµÄÅضČŌŚŹµŃéŹŅÖŠ½ųŠŠČēĻĀŹµŃ飮ĒėÄćĶź³ÉĻĀĮŠĢīæÕ£ŗ| ŹµŃ鱹ŗÅ | NaOHČÜŅŗµÄÅØ¶Č£Ømol/L£© | NaOHČÜŅŗµÄĢå»ż £ØmL£© | “ż²āŃĪĖįČÜŅŗµÄĢå»ż£ØmL£© |
| 1 | 0.10 | 20.00 | |
| 2 | 0.10 | 18.56 | 20.00 |
| 3 | 0.10 | 18.54 | 20.00 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğøŹĖąŹ”ø߶žÉĻ10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
°±Ė®ÖŠĖłŗ¬µÄ·Ö×ÓŗĶĄė×ÓÓŠ 
¢ŁNH4+ ¢ŚH2O ¢ŪNH3 ¢ÜNH3”¤H2O ¢ŻH£« ¢ŽOH£
A£®¢Ł¢Ś¢Ū B£®¢Ś¢Ū¢Ü¢Ż C£®¢Ś¢Ū¢Ü¢Ż¢Ž D£®¢Ł¢Ś¢Ū¢Ü¢Ż¢Ž
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģ°²»ÕŹ”»ĘɽŹŠøßČżÉĻŌĀ漶ž»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
Cyrneine A¶ŌÖĪĮĘÉń¾ĻµĶ³¼²²”ÓŠ×ÅŗÜŗƵÄĮĘŠ§”£æÉÓĆĻćĒŪĶŖ¾¹ż¶ą²½·“Ó¦ŗĻ³É£ŗ £¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
A£®ĻćĒŪĶŖµÄ·Ö×ÓŹ½ĪŖC10H14O
B£®Cyrneine AæÉŅŌ·¢Éś¼Ó³É·“Ó¦”¢ĻūČ„·“Ó¦ŗĶŃõ»Æ·“Ó¦
C£®ĻćĒŪĶŖŗĶCyrneine A¾łÄÜŹ¹ĖįŠŌKMnO4ČÜŅŗĶŹÉ«
D£®ÓėĻćĒŪĶŖ»„ĪŖĶ¬·ÖŅģ¹¹Ģ壬·Ö×ÓÖŠÓŠ4ÖÖ²»Ķ¬»Æѧ»·¾³µÄĒāŌ×ӵķӥą»ÆŗĻĪļ¹²ÓŠ3ÖÖ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģÖŲĒģŅ»ÖŠøßČżÉĻѧʌµŚ¶ž“ĪŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŹµŃéĢā
2Zn(OH)2”¤ZnCO3ŹĒÖʱø»īŠŌZnOµÄÖŠ¼äĢ壬ŅŌŠæ±ŗÉ°£ØÖ÷ŅŖ³É·ÖĪŖZnO£¬ŗ¬ÉŁĮæCu2”¢Mn2+µČĄė×Ó£©ĪŖŌĮĻÖʱø2Zn(OH)2”¤ZnCO3µÄ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ
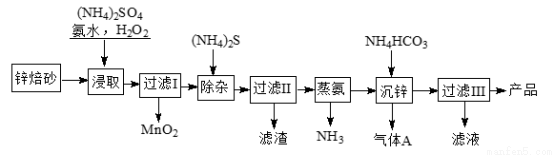
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©µ±(NH4)2SO4”¢NH3”¤H2OµÄ»ģŗĻČÜŅŗÖŠ“ęŌŚc(NH4+)£½2c(SO42?)Ź±£¬ČÜŅŗ³Ź £ØĢī”°Ėį”±”¢”°¼ī”±»ņ”°ÖŠ”±£©ŠŌ”£
£Ø2£©”°½žČ””±Ź±ĪŖĮĖĢįøߊæµÄ½ž³öĀŹ£¬æɲÉČ”µÄ“ėŹ©ŹĒ £ØČĪŠ“Į½ÖÖ£©”£
£Ø3£©”°½žČ””±Ź±¼ÓČėµÄNH3”¤H2O¹żĮæ£¬Éś³ÉMnO2µÄĄė×Ó·½³ĢŹ½ĪŖ ”£
£Ø4£©ŹŹĮæS2?Äܽ«Cu2+Įņ»ÆĪļ³Įµķ¶ų³żČ„£¬ČōŃ”ŌńZnS½ųŠŠ³żŌÓ£¬ŹĒ·ńæÉŠŠ£æÓĆ¼ĘĖćĖµĆ÷ŌŅņ£ŗ ”£
[ŅŃÖŖ£ŗKsp(ZnS)£½1.6”Į10?24£¬Ksp(CuS)£½1.3”Į10?36£»Ņ»°ćČĻĪŖ·“Ó¦µÄĘ½ŗā³£ŹżK£¾105£¬øĆ·“Ó¦½ųŠŠ»ł±¾ĶźČ«”£]
£Ø5£©”°³ĮŠæ”±µÄĄė×Ó·½³ĢŹ½ĪŖ___________________”£
£Ø6£©ÉĻŹöĮ÷³ĢÖŠ¶ą“ĪŠčŅŖ¹żĀĖ£¬ŹµŃéŹŅ½ųŠŠ¹żĀĖ²Ł×÷ŠčŅŖÓƵ½µÄ²£Į§ŅĒĘ÷ÓŠ__________”£”°¹żĀĖIII”±ĖłµĆĀĖŅŗæÉŃ»·Ź¹ÓĆ£¬²śĘ·ŠčĻ“µÓøÉŌļŗó±øÓĆ£¬¼ģŃé²śĘ·Ļ“µÓøɾ»µÄ²Ł×÷ŗĶĻÖĻóŹĒ_______________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x£ØHI£© | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x£ØHI£© | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
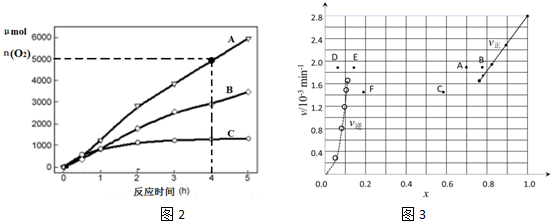
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
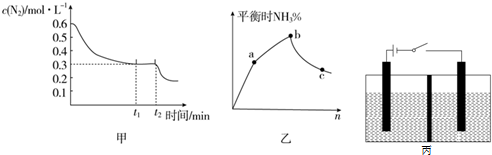
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ŃŠ¾æNO2”¢SO2”¢COµČ“óĘųĪŪČ¾ĘųĢåµÄ“¦Ąķ¾ßÓŠÖŲŅŖŅāŅ壮
ŃŠ¾æNO2”¢SO2”¢COµČ“óĘųĪŪČ¾ĘųĢåµÄ“¦Ąķ¾ßÓŠÖŲŅŖŅāŅ壮²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Na2CO3 | B£® | AlCl3 | C£® | NaCl | D£® | KHSO4 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com