
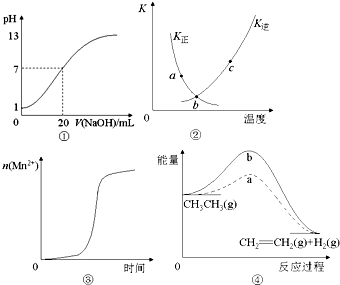
| A. | 图①表示25℃时,用0.1 mol•L-1NaOH溶液滴定20 mL 0.1 mol•L-1 盐酸溶液,溶液的pH随加入NaOH溶液体积的变化 | |
| B. | 图②中表示反应2SO2(g)+O2(g)?2SO3(g);△H<0的有关曲线,图中a.b.c三点中只有b点已经达到化学平衡状态. | |
| C. | 图③表示10 mL 0.01 mol•L-1KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4 溶液混合时,n(Mn2+) 随时间的变化(Mn2+对该反应有催化作用) | |
| D. | 图④中a、b曲线分别表示反应CH3CH3→CH2=CH2 (g)+H2(g);△H>0使用和未使用催化剂时,反应过程中的能量变化 |
分析 A.酸碱中和的时候pH会突变;
B.曲线表示平衡常数与温度的关系,曲线上各点都是平衡点;
C.Mn2+对该反应有催化作用;
D.由图象可知反应物的总能量大于生成物的总能量.
解答 解:A.用0.1 mol•L-1NaOH滴定20 mL 0.1 mol•L-1HCl溶液的pH随加入盐酸体积的变化,pH会突变,故A错误;
B.曲线表示平衡常数与温度的关系,曲线上各点都是平衡点,故B错误;
C.开始时没有锰离子,所以反应速率较小,随着反应的进行,高锰酸根离子被草酸还原生成锰离子,导致反应速率加快,所以锰离子物质的量迅速增大,故C正确;
D.由图象可知反应物的总能量大于生成物的总能量,所以该反应为放热反应,故D错误;
故选C.
点评 本题考查图象分析,为高频考点,涉及酸碱中和滴定、平衡常数与温度关系、催化剂对反应速率影响、反应热等知识点,明确反应原理及曲线含义是解本题关键,易错选项是A,注意酸碱中和时pH值的突变,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在两支试管中分别加入3mL稀盐酸(均足量),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中.
在两支试管中分别加入3mL稀盐酸(均足量),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中.| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
| ① | 50mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2gNa2CO3固体 | 20℃ | 23.3℃ |
| ③ | 35mL稀盐酸 | 含2.5gNaHCO3的 饱和溶液15mL | 20℃ | 18.8℃ |
| ④ | 50mL稀盐酸 | 含3.2gNa2CO3的 饱和溶液15mL | 20℃ | 21.2℃ |
| ⑤ | 50mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 17.4℃ |
| ⑥ | 50mL稀盐酸 | 3.2gNa2CO3固体 | 20℃ | 24.4℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A | Fe2+、NO3-、K+ | 稀H2SO4 | 3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O |
| B | Fe3+、I-、ClO- | NaOH溶液 | Fe3++3OH-═Fe(OH)3↓ |
| C | Mg2+、HCO3-、Cl- | NaOH溶液 | HCO3-+OH-═CO32-+H2O |
| D | Al3+、Cl-、NO3- | 稀氨水 | Al3++3OH-═Al(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制取乙炔时,用饱和食盐水代替蒸馏水,以得到平稳的气流 | |
| B. | 除去苯中的少量苯酚:加入适量NaOH溶液,振荡、静置、分液 | |
| C. | 检验蔗糖水解产物,可向水解样品中直接加入银氨溶液做银镜反应的实验 | |
| D. | 钠和乙醇的反应现象,钠沉在试管底部,有气泡,反应缓慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有的化学反应都伴随着物质变化和能量变化 | |
| B. | 断裂化学键要吸收能量、形成化学键要释放能量是化学反应中能量变化的主要原因 | |
| C. | 吸热反应是一定需要加热才能发生的反应 | |
| D. | 根据反应物总能量和生成物总能量的相对大小可判断反应是释放能量还是吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子数相同,中子数不同的两种微粒的互称 | |
| B. | 电子数不同,中子数相同的多种原子间的互称 | |
| C. | 质子数相同,电子数不同的同一元素微粒 | |
| D. | 质子数相同,中子数不同的原子间的互称 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着元素原子序数的递增,原子最外层电子数总是从 1~8 重复出现 | |
| B. | 随着原子序数的递增,元素的最高正化合价从+1到+7,负价从-7到-1重复出现 | |
| C. | 第3周期中,随着核电荷数的递增,元素的离子半径依次减小 | |
| D. | 随核电荷数递增,ⅦA族元素单质熔、沸点升高,碱金属元素单质熔、沸点降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com