
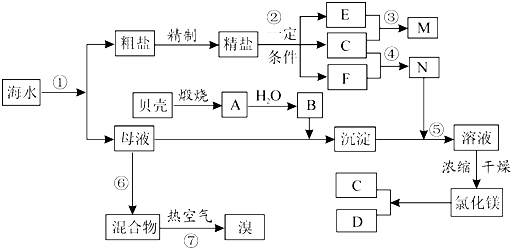


科目:高中化学 来源: 题型:
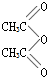 ,
,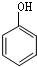 +AS
+AS| H+ |
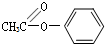 +CH3COOH
+CH3COOH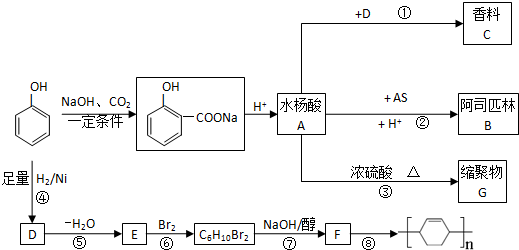
查看答案和解析>>
科目:高中化学 来源: 题型:
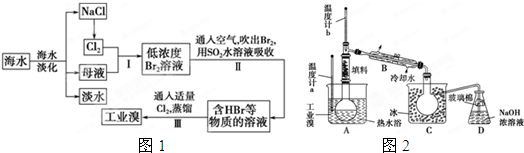
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧气与氢气的混合气体 |
| B、0.05mol的氢气 |
| C、大于0.05mol的氢气 |
| D、小于0.05mol的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用排水法收集气体后,先移出导气管,后熄灭酒精灯 |
| B、在用二氧化锰和浓盐酸制氯气时,在加入二氧化锰后应首先加入浓盐酸,然后再点燃酒精灯 |
| C、在用固体氯化铵和氢氧化钙制取氨气结束后,将大试管从铁架台上取下置于石棉网上冷却后再洗涤 |
| D、钠与水反应时,只能取黄豆粒大小的钠投入盛水的烧杯中反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
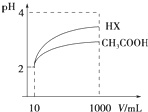 (1)常温下0.1mol?L-1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是
(1)常温下0.1mol?L-1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是| c(H+) |
| c(CH3COOH) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
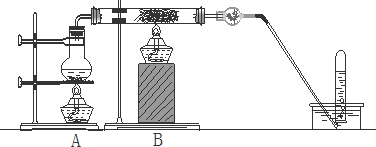
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com