
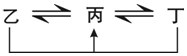
 有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属.A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、并能使红色湿润石蕊试纸变蓝,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族.下图中均含D或F元素的物质均会有图示转化关系:
有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属.A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、并能使红色湿润石蕊试纸变蓝,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族.下图中均含D或F元素的物质均会有图示转化关系: .
.分析 A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属,A元素原子核内只有一个质子,则A为H元素;C元素原子的最外层电子数是其电子层数的3倍,则C原子核外有2个电子层,最外层电子数为6,则C为O氧元素;E与C同主族,则E为S元素;元素A与B形成的气态化合物甲具有10e-、并能使红色湿润石蕊试纸变蓝,则B为N元素,甲为NH3; D、F为常见金属元素,若均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应,D为Al元素,则丙为Al(OH)3,乙、丁分别为AlO2-、Al3+中的一种;若均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应,F元素为第四周期元素,则F为Fe元素,乙为Fe单质、丙为Fe2+、丁为Fe3+,据此解答.
解答 解:(1)根据以上分析,化合物甲为NH3,其电子式为: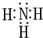 ,故答案为:
,故答案为: ;
;
(2)F为Fe元素,位于周期表中第四周期第Ⅷ族;非金属性O>S,故氢化物稳定性H2O大于H2S,
故答案为:第四周期第Ⅷ族;大于;
(3)乙、丁分别为AlO2-、Al3+中的一种,二者反应离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(4)亚铁离子具有还原性,被酸性高锰酸钾氧化生成铁离子,其对应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
点评 本题考查元素及无机物的推断、常用化学用语、元素化合物的性质等,难度较大,侧重对学生综合能力的考查,需要学生具备扎实的基础.


科目:高中化学 来源: 题型:选择题
| A. | 1.8 g D2O含有NA个中子 | |
| B. | 标准状况下,22.4 L己烷中共价键数目为19NA | |
| C. | 5.35 g NH4Cl固体中含有N-H键的个数为0.4NA | |
| D. | 常温下将0.1 mol Fe投入足量的浓硝酸中,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na[Al(OH)4]溶液中通入足量CO2:2[Al(OH)4]-+CO2═2Al(OH)3↓+CO32-+H2O | |
| B. | 二氧化硅和氢氧化钠溶液反应:SiO2+2Na++2OH-═Na2SiO3+H2O | |
| C. | 铜和氯化铁溶液反应:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 碳酸钡和稀硝酸反应:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | XZ线上任意点均呈中性,pH=7 | |
| B. | 两条曲线间任意点均有c(H+)•c(OH-)=Kw | |
| C. | M区域内任意点均有c(H+)<c(OH-) | |
| D. | 图中T1<T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 含有5种官能团 | |
| B. | 分子式为C9H9O6 | |
| C. | 可以发生取代、加成、消去、氧化反应 | |
| D. | 核磁共振氢谱具有6个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
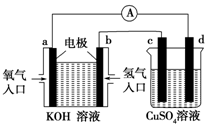 (1)用作橡胶工业的硫化剂S2Cl2的分子结构中每个原子均满足8电子稳定结构,①试写出S2Cl2的电子式
(1)用作橡胶工业的硫化剂S2Cl2的分子结构中每个原子均满足8电子稳定结构,①试写出S2Cl2的电子式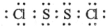 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(3) | B. | (1)(2)(5) | C. | (2)(3)(5) | D. | (2)(4)(5) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com