
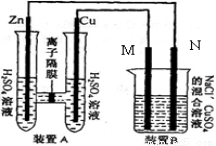
(4分)下图装置B中是浓度均为0.1mol/L的NaCl、CuSO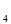 混合溶液,溶液体积为500ml,M、N均为石墨电极,当装置A中Zn棒质量减少6.5g时,N上质量增加____________g;此时,所有电极上总共收集到的气体的总体积为___________L(换算成标准状况下的体积)。
混合溶液,溶液体积为500ml,M、N均为石墨电极,当装置A中Zn棒质量减少6.5g时,N上质量增加____________g;此时,所有电极上总共收集到的气体的总体积为___________L(换算成标准状况下的体积)。
(1)3.2 (2)4.76
【解析】
试题分析:A为原电池锌为负极、同为正极,B为电解池,M为阳极、N为阴极。装置中每个电极转移电子数相等,A中Zn棒质量减少6.5g时转移电子0.2mol;铜电生成氢气,转移电子0.2mol生成氢气0.1mol;M电极为阳极,转移0.2mol电子时,先后发生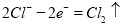 、
、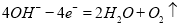 ,溶液中共含0.05mol NaCl,生成氯气0.025mol,生成氧气0.0375 mol;N电极为阴极,先后发生
,溶液中共含0.05mol NaCl,生成氯气0.025mol,生成氧气0.0375 mol;N电极为阴极,先后发生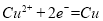 、
、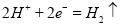 ,溶液中共含0.05mol CuSO
,溶液中共含0.05mol CuSO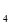 ,生成0.05mol Cu和0.05 mol氢气,所以共生成气体0.2125mol,标准状况下的体积为4.76L。
,生成0.05mol Cu和0.05 mol氢气,所以共生成气体0.2125mol,标准状况下的体积为4.76L。
考点:本题考查电解池、原电池综合计算。


科目:高中化学 来源:2014秋湖北省武汉市高二上学期期中联考化学试卷(解析版) 题型:选择题
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是
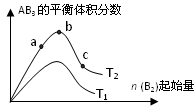
A.反应速率a>b>c
B.若T2>T1,则正反应一定是吸热反应
C.达到平衡时,AB3的物质的量大小为:b > c > a
D.达到平衡时A2的转化率大小为:b>a>c
查看答案和解析>>
科目:高中化学 来源:2014秋湖北省武汉市高一上学期期中联考化学试卷(解析版) 题型:选择题
在除杂质过程中要尽量除去杂质,那么加入的试剂必须过量,最后过量试剂用物理或化学方法除去。现要除去NaCl溶液中的CaCl2、Na2SO4,下列选用试剂和使用顺序正确的是
A.Na2CO3、BaCl2、HCl B.BaCl2、Na2CO3、H2SO4
C.BaCl2、Na2CO3、HCl D.Ba(NO3)2、Na2CO3、HCl
查看答案和解析>>
科目:高中化学 来源:2014秋湖北省武汉市高一上学期期中联考化学试卷(解析版) 题型:选择题
设NA 表示阿伏加德罗常数,数值约为6.02×1023。下列说法正确的是
A.1 L 0.1mol·L-1的NaHCO3溶液中含有阳离子的物质的量为0.2mol
B.0.1 mol水蒸气在标准状况下体积为2.24 L
C.在25℃,1.01×105 Pa时,11.2 L氧气所含的氧原子数目为6.02×1023
D.标准状况下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24 L
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高二上学期期中考试化学试卷(解析版) 题型:填空题
(10分)如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
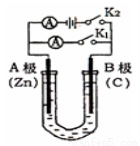
(1)打开K2,合并K1,若所盛溶液为CuSO4溶液:则A为 极,A极的电极反应式为 。若所盛溶液为KCl溶液:则B极的电极反应式为
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则A电极附近可观察到的现象是 ,Na+移向 极(填A、B);B电极上的电极反应式为 ,总反应化学方程式是 。
(3)如果要用电解的方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是 (填“粗铜”或“纯铜”),电极反应式是 ,反应一段时间后电解质溶液中Cu2+的浓度将会 (填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高二上学期期中考试化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.铁在潮湿空气中生锈是自发过程
B.电解池的反应是属于自发反应
C.NH4NO3溶于水吸热,说明其溶于水不是自发过程;
D.非自发反应在任何条件下一定都不能发生。
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高一上学期期中考试化学试卷(解析版) 题型:实验题
(12分)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
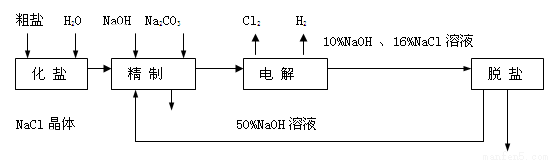
依据上图,完成下列填空:
(1)写出电解饱和食盐水的化学方程式 。
(2)如果粗盐中SO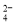 含量较高,必须添加钡试剂除去SO
含量较高,必须添加钡试剂除去SO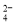 ,该钡试剂可以是 (选填A、B、C,多选扣分)
,该钡试剂可以是 (选填A、B、C,多选扣分)
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(3)判断钡试剂已经过量的方法是 。
(4)为有效除去Ca2+、Mg2+、SO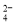 ,加入试剂的合理顺序为 (选填A,B,C多选扣分)
,加入试剂的合理顺序为 (选填A,B,C多选扣分)
A.先加NaOH溶液,后加Na2CO3溶液,再加钡试剂
B.先加NaOH溶液,后加钡试剂,再加Na2CO3溶液
C.先加钡试剂,后加NaOH溶液,再加Na2CO3溶液
(5)为检验精盐纯度,需配制150 mL0.2 mol/LNaCl(精盐)溶液,下图是该同学转移溶液的示意图,
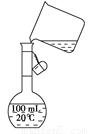
图中的错误是 。
关于该配制过程中,下列说法正确的是________。
A.应称取氯化钠晶体的质量为1.755 g
B.洗涤液不需要转移到容量瓶中
C.定容时,由于同学仰视,将导致所配溶液浓度偏低
D.摇匀后静置,发现液面低于刻度线,应继续加水至凹液面与刻度线相切
查看答案和解析>>
科目:高中化学 来源:2014秋河北省、临漳一中、永年二中高二上学期期中联考化学试卷(解析版) 题型:选择题
在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
则25 ℃时,反应X+3Y? ?2Z的平衡常数为
?2Z的平衡常数为
A.500 B.600 C.1 200 D.1 600
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com