
分析 若某酸性溶液中Fe3+和Mg2+离子都是0.010mol/L,根据Ksp(Fe(OH)3)=2.79×10-39、Ksp(Mg(OH)2)=5.61×10-12计算Fe(OH)3完全沉淀时溶液中氢氧根离子浓度和生成Mg(OH)2沉淀时溶液中氢氧根离子的浓度,然后计算pH.
解答 解:当[Fe3+]≤1×10-6mol/L为沉淀完全,则当Fe3+完全沉淀时,c(OH-)=$\root{3}{\frac{Ksp(Fe({OH)}_{3})}{c(F{e}^{3+})}}$=$\root{3}{\frac{2.79×1{0}^{-39}}{1×1{0}^{-6}}}$=1.41×10-11mol/L,此时溶液中c(H+)=7.1×10-4mol/L,则pH≈3.15;生成Mg(OH)2沉淀时溶液中氢氧根离子的浓度c(OH-)=$\sqrt{\frac{Ksp(Mg({OH)}_{2})}{c(M{g}^{2+})}}$=$\sqrt{\frac{5.61×1{0}^{-12}}{0.01}}$=2.37×10-5mol/L,则c(H+)=4.22×10-10mol/L,
pH≈9.4,所以两者分离的pH范围3.15<pH<9.4;
答:可计算出两者分离的pH范围:3.15<pH<9.4.
点评 本题主要考查溶度积常数的概念和有关计算,题目难度中等,注意把握根据溶度积常数计算溶液pH的方法,侧重于考查学生的分析能力和计算能力.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:选择题
| A. | c(H+)=10-6 mol•L-1的溶液一定呈酸性 | |
| B. | PH=7的溶液一定呈中性 | |
| C. | c(OH-)=c(H+)的溶液一定呈中性 | |
| D. | 不能使酚酞试液变红的溶液一定呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
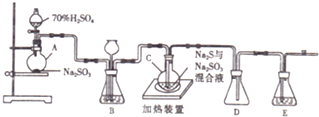
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
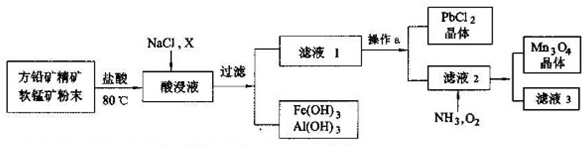
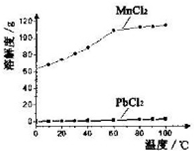
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
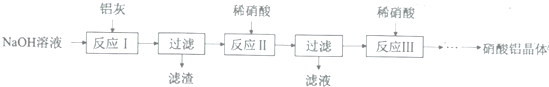
| 氢氧化物 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 4.2 |
| 沉淀完全pH | 3.2 | 5.4 |
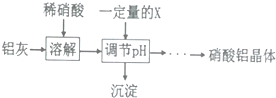
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y和 Z的原子半径大小顺序为 Y>Z>X | |
| B. | Z和 Y组成的化合物中一定既有离子键又有共价键. | |
| C. | 元素 X、Y、W各自最高和最低化合价的代数和分别为 0、4、4 | |
| D. | 同时含有 X、Y、Z、W四种元素的两种不同化合物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78g过氧化钠中存在的共价价键总数为2NA | |
| B. | 22.4L(标准状况)氯气充分参与化学反应,转移的电子数不一定为2NA | |
| C. | 1 L0.1 mol•L-1的NaHS溶液中HS-、S2-和H2S粒子数之和小于0.1NA | |
| D. | 一定条件下,密闭容器中2molSO2与1molO2充分反应,产物的分子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com