
【题目】下列各组物质中,能一步实现下图所示①~⑤转化关系的是

X | Y | Z | W | |
A | C | CO | CO2 | Na2CO3 |
B | Fe3O4 | Fe | FeCl2 | FeCl3 |
C | H2SO4 | SO2 | S | SO3 |
D | Al | Al2O3 | NaAlO2 | Al(OH)3 |
A. A B. B C. C D. D
【答案】B
【解析】试题分析:A.碳燃烧生成CO,CO氧化得到CO2,CO2和碳酸钠之间可以相互转化,但CO不能直接生成碳酸钠,故A错误;B.Al与Fe3O4反应生成Fe,Fe与盐酸反应生成FeCl2,Fe与氯气反应生成FeCl3,FeCl2与氯气反应FeCl3,FeCl3与Fe反应生成FeCl2,故B正确;C.硫酸与Cu反应生成二氧化硫,二氧化硫与硫化氢反应生成S,二氧化硫与氧气反应生成三氧化硫,S不能一步转化为SO3,故C错误;D.Al与氧气反应生成Al2O3,Al2O3与NaOH反应生成NaAlO2,Al2O3不能直接转化为Al(OH)3,NaAlO2与少量酸反应生成Al(OH)3,Al(OH)3与NaOH反应生成NaAlO2,故D错误;答案为B。


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】(1)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是___________(用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是_______________。
(2)在25 ℃时,下图为向25mL 0.1 mol·L-1 NaOH溶液中逐滴加0.2 mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。请回答:
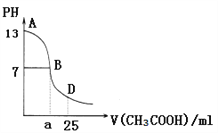
①当25mL 0.1 mol·L-1 NaOH溶液和0.2 mol·L-1 CH3COOH溶液恰好完全反应时所得溶液显_______(选填“酸性”“碱性”或“中性”),其原因为__________________________(用离子方程式表示)。
②B点时溶液中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为__________。
③AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是______。
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
④在D点时,溶液中c(CH3COO-)+c(CH3COOH)_____2c(Na+)(选填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300mL Al2(SO4)3溶液中,含Al3+为1.62g,在该溶液中加入0.1molL﹣1 Ba(OH)2溶液100mL,反应后溶液中SO42﹣的物质的量浓度约为( )
A.0.4 molL﹣1
B.0.3 molL﹣1
C.0.2 molL﹣1
D.0.1 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积固定为3 L的某密闭容器中加入1 mol A、2 mol B,一定温度下发生如下反应:A(s)+2B(g)![]() C(g)+D(g),经反应5 min后,测得C的浓度为0.3 mol·L-1。则下列说法中正确的是
C(g)+D(g),经反应5 min后,测得C的浓度为0.3 mol·L-1。则下列说法中正确的是
A. 5 min内D的平均反应速率为0.02 mol·L-1·min-1
B. 5 min内A的平均反应速率为0.06 mol·L-1·min-1
C. 经5 min后,向容器内再加入C,正反应速率变小
D. 平衡状态时,生成1 mol D时同时生成1 mol A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)体积相同,浓度均为0.2 mol·L-1的盐酸和CH3COOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为_______。
(2)体积相同,浓度均为0.2 mol·L-1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为_______。
(3)体积相同,pH均等于1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为_______。
(4)体积相同,pH均等于13的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为_______。
(5)将等体积等物质的量浓度的盐酸和氨水混合后,溶液呈______性(填“酸”、“中”或“碱”,下同),溶液中c(NH![]() )_______c(Cl-)(“>”、“=”或“<”)。
)_______c(Cl-)(“>”、“=”或“<”)。
(6)pH=3的盐酸和pH=11的氨水等体积混合后,溶液呈_______性(填“酸”、“中”或“碱”),溶液中c(NH![]() )________c(Cl-)(“>”、“=”或“<”)。
)________c(Cl-)(“>”、“=”或“<”)。
(7)写出NaHCO3在水溶液中的电离方程式___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的_________区;溴的价电子排布式为_________;
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2 形式存在的。使氢氟酸分子缔合的作用力是________;
(3)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图 I、 II 所示:
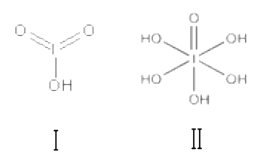
请比较二者酸性强弱: HIO3_____ (填“>”、“<”或“=”)H5IO6;
(4)已知 ClO2- 为 V 形结构,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体_________;
(5)如图为碘晶体晶胞结构。有关说法中正确的是_____________。
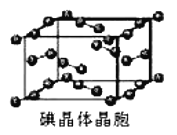
A.碘分子排列有2 种不同取向,2 种取向不同的碘分子以4 配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有 4 个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
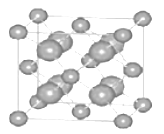
(6)已知 CaF2 晶体(如图)的密度为 ρg/cm3, NA为阿伏加德罗常数,棱上相邻的两个 Ca2+的核间距为 a cm,则CaF2 的相对分子质量可以表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的用途说法不正确的是
A. Si 可用于制造光导纤维 B. 钠、钾合金可用于原子反应堆作热交换剂
C. FeCl3 溶液可作为铜质电路板蚀刻剂 D. 漂白粉可用于自来水杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是___________________。
(2)滤液1中加入H2O2溶液的目的是________________________________。
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂为________________。
(4)已知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式___________________________________。
(5)由滤液2生成Ce(OH)4的离子方程式_____________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,请用离子方程式解释其作用原理:______________________________,相对于去除中性废水,其在去除酸性废水中的悬浮物时效率_________(填“增强”或“降低”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com