

| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ?mol-1 | 198 | 360 | 498 | X |


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
 (1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是
(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是 CO2+NO,2min时,测得容器中NO的物质的量为0.2mol,则:
CO2+NO,2min时,测得容器中NO的物质的量为0.2mol,则:查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的总能量 (填“>”、“<”或“=”)CO2和NO的总能量。
(2)在某体积为2L的密闭容器中充入0.5mol NO2和1mol CO,在一定条件下发生反应:NO2+COCO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
①该段时间内,用CO2表示的平均反应速率为 。
②假设此反应在5 min时达到平衡,则此时容器内气体的总物质的量为 。
③下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是
A.容器内气体的质量保持变 B.NO2的物质的量浓度不再改变
C.容器内气体的平均相对分子质量不变 D.NO2的消耗速率与CO2的消耗速率相等
E.容器内气体的物质的量保持不变
查看答案和解析>>
科目:高中化学 来源:2011-2012年湖南凤凰华鑫中学高一下学期第三次月考(理)化学试卷(带解析) 题型:填空题
(8分)(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的总能量 (填“>”、“<”或“=”)CO2和NO的总能量。
(2)在某体积为2L的密闭容器中充入0.5mol NO2和1mol CO,在一定条件下发生反应:NO2+CO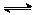 CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
①该段时间内,用CO2表示的平均反应速率为 。
②假设此反应在5 min时达到平衡,则此时容器内气体的总物质的量为 。
③下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是
| A.容器内气体的质量保持变 | B.NO2的物质的量浓度不再改变 |
| C.容器内气体的平均相对分子质量不变 | D.NO2的消耗速率与CO2的消耗速率相等 |
查看答案和解析>>
科目:高中化学 来源:2014届江西上饶中学高一零点、实验班下期末化学试卷(解析版) 题型:填空题
(8分)(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的总能量 (填“>”、“<”或“=”)CO2和NO的总能量。

(2)在某体积为2L的密闭容器中充入0.5mol NO2和1mol CO,在一定条件下发生反应:
NO2+CO CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
①该段时间内,用CO2表示的平均反应速为 。
②假设此反应在5 min时达到平衡,则此时容器内气体的总物质的量为 。
③下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是
A.容器内气体的质量保持变 B.NO2的物质的量浓度不再改变
C.容器内气体的平均相对分子质量不变 D.NO2的消耗速率与CO2的消耗速率相等
E.容器内气体的物质的量保持不变
查看答案和解析>>
科目:高中化学 来源:2011-2012年湖南凤凰华鑫中学高一下学期第三次月考(理)化学试卷(解析版) 题型:填空题
(8分)(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的总能量 (填“>”、“<”或“=”)CO2和NO的总能量。

(2)在某体积为2L的密闭容器中充入0.5mol NO2和1mol CO,在一定条件下发生反应:NO2+CO CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
①该段时间内,用CO2表示的平均反应速率为 。
②假设此反应在5 min时达到平衡,则此时容器内气体的总物质的量为 。
③下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是
A.容器内气体的质量保持变 B.NO2的物质的量浓度不再改变
C.容器内气体的平均相对分子质量不变 D.NO2的消耗速率与CO2的消耗速率相等
E.容器内气体的物质的量保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com