
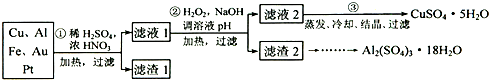
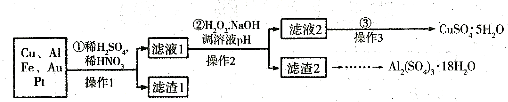
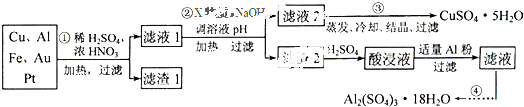
电子产品产生的大量电子垃圾对环境构成了极大的威胁。某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

按要求回答下列问题:
(1)滤渣1中存在的金属有_____________。
(2)已知沉淀物的pH如下表:
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe2+ |
7.0 |
9.0 |
|
Fe3+ |
1.9 |
3.7 |
|
Cu2+ |
4.9 |
6.7 |
|
Al3+ |
3.0 |
4.4 |
①则操作②中X物质最好选用的是___________(填编号)
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是________________________。
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是____________________。
(4)用一个离子方程式表示在酸浸液中加入适量铝粉的反应:___________________。
(5)由CuSO4·5H2O制备CuSO4时,应把CuSO4·5H2O放在______(填仪器名称)中加热脱水。
(6)现在某些电器中使用的高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2
+ 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。
3Zn(OH)2
+ 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。
(15分,除标明1分外,其余每空均为2分) (1)Au、Pt(对一个给1分,错一个倒扣1分)
(2)①d ;②4.4≤pH<4.9(1分,或大于等于4.4,小于4.9;或[4.4,4.9);其它合理均正确,但要准确:大于等于4.4,小于4.9。如果不准确该空不得分。)
(3)①取少量滤液于试管中,②向其中加入少量KSCN溶液,如果溶液不变红证明不存在Fe3+,③继续向溶液中滴入新制的氯水,如果溶液不变红证明不存在Fe2+。(三点少一点扣1分,扣完为止。其它答案合理酌情给分。)
(4)Al+ Fe3+=Fe+Al3+(如果有加氢离子的也给分) (5)坩埚(1分,字错误不得分)
(6) Zn—2e— +2OH—= Zn(OH)2;3(1分);Fe(OH)3—3e— + 5OH— = FeO42- + 4H2O
【解析】
试题分析:(1)向混合物中加稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe被硝酸氧化,而Au或Pt不能被硝酸氧化,所以滤渣1的成分是Pt和Au。
(2)①滤液1中的含有的金属阳离子Cu2+、Al3+、Fe2+,根据沉淀氢氧化物时的pH值可知,要得到硫酸铜硫酸铜晶体,需要形成氢氧化铁或氢氧化铝晶体。由于溶液中含有亚铁离子,而亚铁离子沉淀时的pH超过铜离子的,所以第②步加入氧化剂的目的是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染,所以最好的是双氧水,答案选d。
②调溶液PH的目的是使Fe3+和Al3+形成沉淀,而铜离子不能形成沉淀,所以理论上应控制溶液pH的范围是4.4≤pH<4.9。
(3)亚铁离子具有还原性,而铁离子能和KSCN溶液发生显色反应,所以检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是①取少量滤液于试管中,②向其中加入少量KSCN溶液,如果溶液不变红证明不存在Fe3+,③继续向溶液中滴入新制的氯水,如果溶液不变红证明不存在Fe2+。(三点少一点扣1分,扣完为止。其它答案合理酌情给分。)
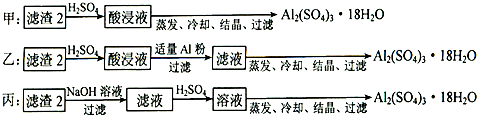
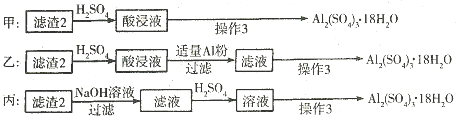
(4)滤渣2的成分为氢氧化铁和氢氧化铝,加入稀硫酸生成硫酸铁和硫酸铝,所以要得到硫酸铝晶体,需要除去铁离子,因此加入单质铝的目的是置换出溶液中的铁,反应的离子方程式是Al+ Fe3+=Fe+Al3+。
(5)固体加热脱水应该在坩埚值完成,所以第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水。
(6)原电池中负极失去电子,发生氧化反应。所以根据总的方程式可知,锌是还原剂,作负极,电极反应式是Zn—2e— +2OH—= Zn(OH)2;铁元素的化合价从+6价降低到+3价,得到3个电子,所以每有1mol K2FeO4被还原,转移电子的物质的量为3mol;充电相当于电解,电解池中阳极失去电子,发生氧化反应,所以根据反应的总方程式可知,充电时阳极电极反应式是Fe(OH)3—3e— + 5OH— = FeO42- + 4H2O。
考点:考查硫酸铝和硫酸铜晶体制备的工艺流程图的有关判断、反应条件的控制、仪器的选择、离子的检验以及电极反应式的有关判断和氧化还原反应的计算等


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| ||
| ||

| c mol?L-1×b×10-3L×250g?mol-1×5 |
| ag |
| c mol?L-1×b×10-3L×250g?mol-1×5 |
| ag |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
| c(Cu2+) |
| c(Ca2+) |
| Ksp(CuCO3) |
| Ksp(CaCO3) |
| c(Cu2+) |
| c(Ca2+) |
| Ksp(CuCO3) |
| Ksp(CaCO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com