
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的反应热△H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应的△H=+566.0 kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
分析 A.H2SO4和Ca(OH)2反应生成硫酸钙沉淀,不仅仅生成水;
B.2molCO完全燃烧放出566kJ的热量,结合盖斯定律判断;
C.反应热与反应条件没有必然关系;
D.燃烧热中水的状态应该是稳定的液态水.
解答 解:A.H2SO4和Ca(OH)2反应生成硫酸钙沉淀,不仅仅生成水,放出更多的热量,则H2SO4和Ca(OH)2反应的反应热△H<2×(-57.3)kJ/mol,故A错误;
B.CO(g)的燃烧热是283.0kJ/mol,CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ/mol,因此2CO2(g)=2CO(g)+O2(g)的反应热为△H=+2×283.0kJ/mol,故B正确;
C.需要加热才能发生的反应不一定是吸热反应,如氢气燃烧、铝热反应等为放热反应,需要加热才能进行,故C错误;
D.101kp下,1mol CH4燃烧生成液态水和二氧化碳所放出的热量是甲烷的燃烧热,水不能为气态,故D错误;
故选B.
点评 本题考查热化学方程式,题目难度不大,明确燃烧热、中和热及盖斯定律的内容为解答关键,注意反应热与反应条件没有必然关系,试题有利于提高学生的分析能力及灵活应用基础知识的能力.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
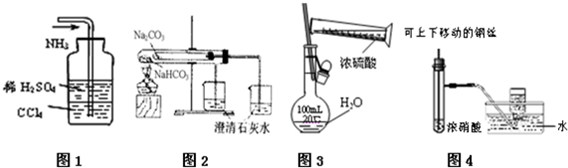
| A. | 图1吸收多余的NH3 | |
| B. | 图2为比较NaHCO3、Na2CO3相对热稳定性 | |
| C. | 图3为配制一定物质的量浓度的硫酸溶液 | |
| D. | 图4为制备并收集少量NO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热 △H=2×(-57.3)kJ•mol-1 | |
| D. | 在101 kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ls22s22p63s23p3 | B. | 1s22s22p3 | C. | 1s22s2sp4 | D. | 1s22s22p63s23p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5Q | B. | Q | C. | 2Q | D. | 5Q |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NCl3属于离子晶体 | B. | NCl3中心氮原子为sp2杂化 | ||
| C. | NCl3空间构型为平面三角形 | D. | NCl3分子属于极性分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com