
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同;基态b原子的核外电子占据3个能级,且最高能级轨道为半充满状态;c的最外层电子数是内层电子数的3倍;d的原子序数是c的两倍;基态e原子3d轨道上有4个单电子。
回答下列问题:
(1)b、c、d电负性最大的是___(填元素符号)。
(2)b单质分子中σ键与π键的个数比为___。
(3)a与c可形成两种二元化合物分子,两种物质可以任意比互溶。其中一种不稳定,可分解产生c的单质,该化合物分子中的c原子的杂化方式为___;这两种物质的互溶物中,存在的化学键有___(填序号)。
①极性共价键 ②非极性共价键 ③离子键 ④金属键 ⑤氢键 ⑥范德华力
(4)这些元素形成的含氧酸中,分子内中心原子的价层电子对数为4的酸是___(填化学式,下同);酸根呈正三角形结构的酸是___,试从两者结构特点判断该酸分子与酸根离子的稳定性:酸分子___酸根离子(填“>”或“<”)。
(5)元素e在周期表中的位置是___区;e的一种常见氯化物中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在,结构式为![]() ,请补写e的元素符号并用“→”表示出其中的配位键___。
,请补写e的元素符号并用“→”表示出其中的配位键___。
【答案】O 1:2 sp3 ①② H2SO4、H2SO3 HNO3 < d 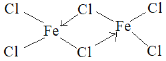
【解析】
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,a为H,基态b原子的核外电子占据3个能级,且最高能级轨道为半充满状态即2p3,则b为N,c的最外层电子数是内层电子数的3倍,则c为O,d的原子序数是c的两倍,d为S,基态e原子3d轨道上有4个单电子,则为3d6,即e为Fe。
A:H,b:N,c:O,d:S,e:Fe。
⑴电负性从左到右依次递增,从上到下依次递减,b、c、d电负性最大的是O,故答案为:O。
⑵b单质分子为氮气,氮气中σ键与π键的个数比为1:2,故答案为:1:2。
⑶a与c可形成两种二元化合物分子,分别为水和过氧化氢,过氧化氢不稳定,过氧化氢的结构式为H—O—O—H,每个氧原子有2个σ键,还有2对孤对电子,因此O原子的杂化方式为sp3,水和过氧化氢互溶物中,水中有共价键,过氧化氢中有极性共价键,非极性共价键,分子之间有范德华力和分子间氢键,但范德华力和分子间氢键不是化学键,因此存在的化学键有①②,故答案为:sp3;①②。
⑷这些元素形成的含氧酸中,有硝酸、亚硝酸、硫酸、亚硫酸,硝酸分子N有3个σ键,孤对电子为0,因此价层电子对数为3,硝酸根价层电子对数为3+0=3,为正三角形;亚硝酸分子N有2个σ键,孤对电子为1,因此价层电子对数为3,亚硝酸根价层电子对数为2+1=3,为“V”形结构;硫酸分子S有4个σ键,孤对电子为0,因此价层电子对数为4,硫酸根价层电子对数为4+0=4,为正四面体结构;亚硫酸分子S有3个σ键,孤对电子为1,因此价层电子对数为4,亚硫酸根价层电子对数为3+1=4,为三角锥形结构,因此分子内中心原子的价层电子对数为4的酸是H2SO4、H2SO3,酸根呈正三角形结构的酸是HNO3;酸分子中心原子带正电荷,吸引氧原子上的电子,使得氧与氢结合形成的电子对易断裂,因此酸分子稳定性 < 酸根离子稳定性,故答案为:H2SO4、H2SO3;HNO3;<。
⑸元素e的价电子为3d64s2,在周期表中的位置是d区,e的一种常见氯化物中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在,中间的Cl与其中易个Fe形成共价键,与另一个Fe形成配位键,Cl提供孤对电子,因此其结构式为 ,故答案为:d;
,故答案为:d; 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】研究与深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁。高炉炼铁过程中发生的主要反应为:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
温度/°C | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
则该反应的平街常数表达式K=_________,H_________0(填“>”、“<”或“=”)。
(2)CO2可用于生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),为探究该反应原理,将1 mol CO2和3 mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应,测得甲醇的物质的量随时间的变化如下图所示。
CH3OH(g)+H2O(g),为探究该反应原理,将1 mol CO2和3 mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应,测得甲醇的物质的量随时间的变化如下图所示。
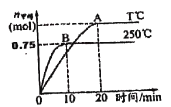
请分析并回答下列问题:
250°C时,反应在前10min的平均速率v(H2)_________molL-1min-1,从反应开始到平衡,CO2转化率为_________%。相同温度下,若某时刻该容器中含有1 mol H2、1.2mol CO2、0.8mol CH3OH、1.5 mol H2O,则此时反应所处的状态为____________________________________(填“向正反应方向进行中”、“向逆反应方向进行中心”或“平衡状态”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图装置进行乙醇氧化反应的探究实验,有关说法不正确的是()
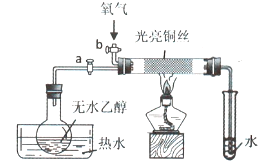
A.热水的作用是促使乙醇挥发,为硬质玻璃管内提供乙醇蒸汽
B.通入乙醇蒸汽反应的过程中,撤离酒精灯后反应仍能进行
C.在硬质玻璃管内发生的主反应为:![]()
D.实验结束时,先停止加热,再关闭活塞a、b,最后将导管移出水面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c,d均是热和电的良导体。下列说法不正确的是
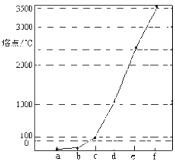
A.e、f单质晶体熔化时克服的是共价键
B.d单质对应元素原子的电子排布式:1s22s22p63s23p2
C.b元素形成的气态氢化物易与水分子之间形成氢键
D.单质a、b、f对应的元素以原子个数比1:1:1形成的分子中含2个σ键,2个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH 、HCl、NH4HSO4中的一种。常温下进行下列实验:
①将1 L pH=3的A溶液分别与0.001mol·L-1 xL B溶液、0.001mol·L-1 yL D溶液充分反应至中性,x、y大小关系为: y<x;
②浓度均为0.1mol·L-1A和E溶液,pH:A<E;
③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)C是______溶液,D是______溶液。
(2)100mL0.01molL﹣1的B溶液与10mL 0.1molL﹣1的B溶液相比较,下列数值中,前者大于后者的是______ (填写序号)
①![]() ②
②![]() ③ c(H+)和c(OH-)的乘积 ④ OH-的物质的量
③ c(H+)和c(OH-)的乘积 ④ OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E ④反应过程的平均速率 E>A
⑤A溶液里有锌粉剩余 ⑥E溶液里有锌粉剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C2H6(g)![]() C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )
C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )
A. 增大容器容积B. 升高反应温度
C. 分离出部分氢气D. 等容下通入惰性气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一密闭容器中充入2mol HI气体,发生反应:2HI(g) ![]() H2(g)+I2(g) ΔH>0 ,达到化学平衡状态后,为使体系颜色加深,可采取的措施是( )
H2(g)+I2(g) ΔH>0 ,达到化学平衡状态后,为使体系颜色加深,可采取的措施是( )
①维持温度和容器体积不变,再充入少量I2(g) ②维持温度和压强不变,再充入2molHI ③降低温度 ④加压(缩小容器体积) ⑤升高温度
A.①④⑤B.②③C.②③④D.①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国电池的年市场消费量约为80亿只,其中![]() 是锌锰干电池,利用废旧锌锰干电池制备硫酸锌晶体
是锌锰干电池,利用废旧锌锰干电池制备硫酸锌晶体![]() 和纯
和纯![]() 的工艺如下图所示:
的工艺如下图所示:
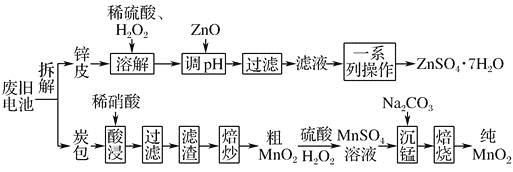
已知:
①锌皮的主要成分为Zn,含有少量Fe;炭包的主要成分为![]() 、
、![]() 、
、![]() 、碳粉等,还含有少量的Cu、Ag、Fe等。
、碳粉等,还含有少量的Cu、Ag、Fe等。
②![]() ;
;![]() ;
;![]() 。
。
(1)除去炭包中碳粉的操作为________。
A.酸浸 ![]() 过滤
过滤 ![]() 焙炒
焙炒 ![]() 焙烧
焙烧
(2)粗![]() 转化为
转化为![]() 时,主要反应的离子方程式为____________________________。
时,主要反应的离子方程式为____________________________。
(3)焙烧时发生反应的化学方程式为__________________________________________。
(4)制备硫酸锌晶体流程中,在溶解时加![]() 的作用是____________________________,用ZnO调节溶液pH的目的是_____________________________。滤液制备硫酸锌晶体
的作用是____________________________,用ZnO调节溶液pH的目的是_____________________________。滤液制备硫酸锌晶体![]() 的一系列操作为:____________、____________、________、洗涤、干燥。
的一系列操作为:____________、____________、________、洗涤、干燥。
(5)“草酸钠![]() 高锰酸钾返滴法”可测定
高锰酸钾返滴法”可测定![]() 的纯度,取
的纯度,取![]() 样品于锥形瓶中,加入适量稀硫酸,再加入足量的
样品于锥形瓶中,加入适量稀硫酸,再加入足量的![]() 溶液,最后用
溶液,最后用![]() 溶液滴定剩余的
溶液滴定剩余的![]() 。其中
。其中![]() 与
与![]() 溶液反应的离子方程式为__________________________________________。
溶液反应的离子方程式为__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com