
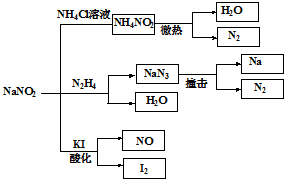
 亚硝酸钠(NaNO2)是一种工业用盐,广泛用于物质合成、金属表面处理等,它的一些性质见如图.下列说法不正确的是( )
亚硝酸钠(NaNO2)是一种工业用盐,广泛用于物质合成、金属表面处理等,它的一些性质见如图.下列说法不正确的是( )| A、NH4NO2的热稳定性大于NaNO2 |
| B、NaN3分解,每产生1molN2转移6mole- |
| C、NaN3可用氨基钠(NaNH2)和N2O在液氨中低温制备,N2O与N3-互为等电子体 |
| D、可用淀粉碘化钾试纸和食醋鉴别NaCl与NaNO2 |
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 (I)如图是某学校林老师制备NH3并进行性质实验时的改进装置.按图1把仪器安装好,称取2g固体氯化铵装入试管底部,再称取2g氢氧化钠覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2mL浓氨水);烧杯内盛滴有酚酞试液的水:把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡.
(I)如图是某学校林老师制备NH3并进行性质实验时的改进装置.按图1把仪器安装好,称取2g固体氯化铵装入试管底部,再称取2g氢氧化钠覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2mL浓氨水);烧杯内盛滴有酚酞试液的水:把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡.查看答案和解析>>
科目:高中化学 来源: 题型:
A、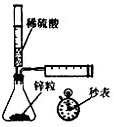 测定一定时间内生成H2的反应速率 |
B、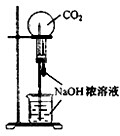 用CO2做喷泉实验 |
C、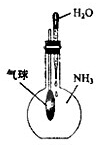 验证NH3易溶于水 |
D、 比较Na2CO3与NaHCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn、Ag |
| B、Cu、Fe |
| C、Al、Fe |
| D、Mg、Al |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2 |
| B、8:1 |
| C、35.5:108 |
| D、108:35.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2ClO3 |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×105 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=1.8×10-11 |
| A、相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
| B、碳酸钠溶液中滴加少量氯水的离子方程式为CO2-3+Cl2+H2O=HCO-3+Cl-+HClO |
| C、向0.1mol?L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5 |
| D、向浓度均为1×10-3mol?L-1的KCl和K2CrO4混合液中滴加1×10-3mol?L-1的AgNO3溶液,CrO2-4先形成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
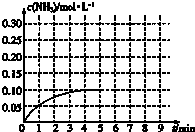 在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图:
在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlCl3溶液与稀氨水 |
| B、FeBr2溶液与Cl2 |
| C、CO2与Na2SiO3溶液 |
| D、澄清石灰水与Ca(HCO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两项 | B、三项 | C、四项 | D、五项 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com