
【题目】氮氧化物(主要为NO和NO2)是大气污染物,如何有效地消除氮氧化物的污染是目前科学家们研究的热点问题。
(1)用尿素[CO(NH2)2]吸收氮氧化物是一种可行的方法。
①尿素在高温条件下与NO2反应转化成无毒气体,该反应的化学方程式为___。用尿素溶液也可吸收氮氧化物,研究表明,当混合气体中![]() =1时,总氮还原率最高,随着,
=1时,总氮还原率最高,随着,![]() 比值增大,总氮还原率降低的主要原因是___。
比值增大,总氮还原率降低的主要原因是___。
②在一个体积为1L的恒容密闭容器中充入1molCO2和1molNH3,在恒定温度下使其发生反应2NH3(g)+CO2(g)![]() NH2CONH2(s)+H2O(g) △H<0并达到平衡,混合气体中氨气的体积分数随时间的变化如图所示。
NH2CONH2(s)+H2O(g) △H<0并达到平衡,混合气体中氨气的体积分数随时间的变化如图所示。
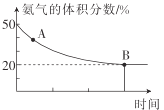
则A点时v正(CO2)___(填“>”“<”或“=”)B点时v正(CO2),原因是___。B点时,NH3的转化率为___。
③下列有关反应2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)的说法正确的是___。
CO(NH2)2(s)+H2O(g)的说法正确的是___。
A.分离出少量的尿素,NH3的转化率将增大
B.反应达到平衡时,降低反应体系的温度,CO2的浓度减小
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高尿素的产率
(2)已知O3氧化氮氧化物的主要反应的热化学方程式如下:
2NO(g)+O2(g)=2NO2(g) △H1=akJ·mol-1
NO(g)+O3(g)=NO2(g)+O2(g) △H2=bkJ·mol-1
6NO2(g)+O3(g)=3N2O5(g) △H3=ckJ·mol-1
则反应4NO2(g)+O2(g)=2N2O5(g)△H=___(用含a、b、c的代数式表示)kJ·mol-1。
(3)氮氧化物也可用碱液吸收。若NO和NO2的混合气体被NaOH溶液完全吸收,只生成一种盐,则该盐的化学式为___;已知常温下Ka(HNO2)=5×10-4,则反应HNO2(aq)+NaOH(aq)![]() NaNO2(aq)+H2O(l)的平衡常数K=___。
NaNO2(aq)+H2O(l)的平衡常数K=___。
【答案】4CO(NH2)2+6NO2![]() 7N2+4CO2+8H2O NO不溶于水,难与尿素反应 > 由A点到B点,温度不变,氨气的体积分数减小,正反应速率减小 75% B
7N2+4CO2+8H2O NO不溶于水,难与尿素反应 > 由A点到B点,温度不变,氨气的体积分数减小,正反应速率减小 75% B ![]() NaNO2 5×1010
NaNO2 5×1010
【解析】
(1)①尿素[CO(NH2)2]在高温条件下与与NO2反应转化成无毒气体,即生成氮气、二氧化碳和水,根据NO不溶于水、和水不反应性质解答;
②利用三段式,求解NH3的转化率;
③根据化学平衡移动原理解答;
(2)利用盖斯定律求解△H;
(3)根据氧化还原反应规律推测生成物;化学平衡常数k定义:化学平衡常数等于生成物浓度幂积与反应物浓度幂积之比,结合Kw的关系式解答。NO和NO2混合气体被NaOH溶液完全吸收,只生成一种盐,该反应中只有N元素化合价发生变化,且NO中N元素化合价为+2、NO2中N元素化合价为+4,则生成的盐中N元素化合价为+3价,即亚硝酸盐。
(1)①尿素[CO(NH2)2]在高温条件下与NO反应转化成三种无毒气体,可生成N2、CO2和水,反应的方程式为4CO(NH2)2+6NO2![]() 7N2+4CO2+8H2O;由于NO不溶于水,和水不反应,所以氮氧化物气体中NO的体积分数越大,总氮还原率降低;
7N2+4CO2+8H2O;由于NO不溶于水,和水不反应,所以氮氧化物气体中NO的体积分数越大,总氮还原率降低;
②恒温条件下,A点氨气体积分数大于B的氨气体积分数,说明A点未达到平衡,反应正向进行,B点达到平衡状态,则A到B的反应过程中,氨气的体积分数减小,正反应速率逐渐减小,有A点v正(CO2)>B点时v正(CO2);
设达到平衡状态时反应了2xmolNH3,有
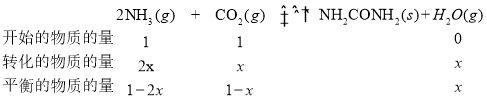
NH3的体积分数为20%,则![]() ,求得x=
,求得x=![]() mol,则NH3的转化率为
mol,则NH3的转化率为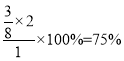 ;
;
③有关反应2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)的说法;
CO(NH2)2(s)+H2O(g)的说法;
A.尿素是固体,浓度是个定值,分离出尿素,浓度不改变,化学反应速率不变,平衡不移动,A错误;
B.该反应是放热反应,降低温度,平衡正向移动,CO2的浓度减小,B正确;
C.根据上问的分析,设达到平衡状态时反应了2xmolNH3,NH3的转化率等于![]() ,CO2的转化率等于
,CO2的转化率等于![]() ,转化率不相等,C错误;
,转化率不相等,C错误;
D.催化剂能够对加快化学反应速率,但不能使平衡发生移动,不能提高尿素的产率,D错误。
答案选B;
(2)①2NO(g)+O2(g)=2NO2(g) △H1=akJ·mol-1
②NO(g)+O3(g)=NO2(g)+O2(g) △H2=bkJ·mol-1
③6NO2(g)+O3(g)=3N2O5(g) △H3=ckJ·mol-1
根据盖斯定律![]() (①+2×③-2×②)得反应4NO2(g)+O2(g)=2N2O5(g),可知△H=
(①+2×③-2×②)得反应4NO2(g)+O2(g)=2N2O5(g),可知△H=![]() (△H1+2
(△H1+2![]() (a+2c-2b);
(a+2c-2b);
(3)NO和NO2混合气体被NaOH溶液完全吸收,只生成一种盐,反应中只有N元素化合价发生变化,且这两种氧化物得失电子相等,NO中N元素化合价为+2、NO2中N元素化合价为+4,则生成的盐中N元素化合价为+3价,为亚硝酸盐,化学式为NaNO2。反应HNO2(aq)+NaOH(aq)![]() NaNO2(aq)+H2O(l)的平衡常数
NaNO2(aq)+H2O(l)的平衡常数![]() (由于Na+实际上没有参与反应过程,因此没有出现在表达式中。),上下同时乘以c(H+),有
(由于Na+实际上没有参与反应过程,因此没有出现在表达式中。),上下同时乘以c(H+),有![]() ,带入数据可得
,带入数据可得![]() 。
。


科目:高中化学 来源: 题型:
【题目】现有容积均为2 L的甲、乙恒容密闭容器,向甲中充入1.5 mol CO2和3 mol H2,乙中充入2 mol CO2、3 mol H2,一定条件下仅发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),实验测得反应体系中CO2的平衡转化率与温度的关系曲线如图所示。下列说法正确的是
CH3OH(g)+H2O(g),实验测得反应体系中CO2的平衡转化率与温度的关系曲线如图所示。下列说法正确的是

A.该反应的ΔH>0
B.曲线Ⅱ表示甲容器中CO2的平衡转化率与温度的关系
C.500 K时,该反应的化学平衡常数为200
D.700 K时,若在上述密闭容器中充入0.9 mol CO2、1.2 mol H2、0.1 mol CH3OH、0.1mol H2O,则达到平衡时,H2的体积分数大于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期的 Cr、Fe、Co、Ni、Cu、Zn 等许多金属能形成配合物。
(1)NH3 是一种很好的配体,氨气分子是_____(填“极性”或“非极性”)分子,NH3 的沸 点_____(填“高于”“等于”或“低于”)AsH3。
(2)科学家通过 X 射线测得胆矾的结构示意图可简单表示如下:

图中虚线表示的作用力为_________________________。
(3)胆矾溶液与氨水在一定条件下可以生成 Cu(NH3)4SO4H2O 晶体。在 Cu(NH3)4SO4·H2O 晶体中,含 有的原子团或分子有:[Cu(NH3)4]2+、NH3、 SO42 、H2O,[Cu(NH3)4]2+为平面正方形结构,则 VSEPR 模型为四面体结构的原子团或分子是_____________,其中心原子的杂化轨道类型是________________ 。
(4)金属镍粉在 CO 气流中轻微加热,生成无色挥发性液态 Ni(CO)4,呈正四面体构型。Ni(CO)4 易溶于_____________________ (填编号)。
a . 水 b. 四氯化碳 c. 苯 d. 硫酸镍溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.铅蓄电池放电时,负极质量减轻,正极增重
B.升高CH3COONa溶液的温度,其水的离子积常数和pH均增大
C.CH3CH=CHCH3分子中的四个碳原子都在一条直线上
D.常温下Ksp(AgBr)=5.0×10-13,Ksp(AgCl)=1.8×10-10,则S(AgBr)>S(AgCl)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁元素是最重要的金属元素之一,其不仅是各种钢材的主要成分,很多含铁化合物也具有重要意义。
(1)按照电子排布,可把元素周期表中的元素划分成五个区,铁元素属于_________区。
(2)Mn2+在水溶液中难被氧化,而Fe2+则易被氧化为Fe3+ ,请从离子的价电子式角度解释Mn2+与Fe2+还原能力的差别:_________。Mn2+的半径_________ Fe3+的半径(填“>”、“<”或“=”)。
(3)金属铁晶体中铁原子采用体心立方堆积,该铁晶体的空间利用率为_________(用含π的式子表示)。
(4)向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的[Fe(SCN)(H2O)5]2+。N、H、O三种元素的电负性由大到小的顺序为_________;[Fe(SCN)(H2O)5]2+中Fe3+的配位数为_________,H2O中氧原子的杂化方式为_________。
(5)二茂铁是一种含铁的有机化合物,其化学式为Fe(C5H5)2,可看作是Fe2+离子与两个正五边形的环戊二烯负离子(C5H![]() )配体形成的夹心型分子(如下图a所示)。已知大π键可用符号Π
)配体形成的夹心型分子(如下图a所示)。已知大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π),则C5H
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π),则C5H![]() 的大π键表示为________。二茂铁是黄色针状晶体,熔点173 ℃(在100 ℃时开始升华),沸点249 ℃,在水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是________(填标号)。
的大π键表示为________。二茂铁是黄色针状晶体,熔点173 ℃(在100 ℃时开始升华),沸点249 ℃,在水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是________(填标号)。
A 离子键 B 配位键 C σ 键 D 范德华力
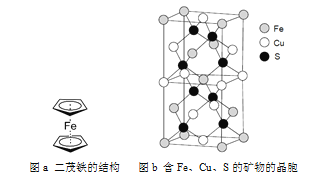
(6)一种含有Fe、Cu、S三种元素的矿物的晶胞(如上图b所示),属于四方晶系(晶胞底面为正方形),晶胞中S原子位于内部,Fe原子位于体心和晶胞表面,Cu原子位于晶胞表面。此矿物的化学式为_________。若晶胞的底面边长为A pm,高为C pm,阿伏伽德罗常数为NA,则该晶体的密度为__________ g/cm3(写出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.100 mL 1 mol·L-1 NaClO溶液中ClO-的数目为0.1NA
B.46 g 75%的C2H5OH溶液中所含O原子数目为0.75NA
C.7.6 g过氧乙酸(CH3COOOH)所含过氧键数目为0.1NA
D.标准状况下,22.4 L 氯气与水充分反应转移电子数目NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《Journal of Energy Chemistry》报导我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:

下列说法不正确的是
A.c为电源的负极
B.a极的电极反应式为:2C2O52- -4e- =4CO2 ↑+O2↑
C.①②中,捕获CO2时碳元素的化合价均未发生变化
D.转移l mol电子可捕获CO2 11.2 L(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
Zn(s)+![]() O2(g)=ZnO(s) ΔH1=-351.1kJ·mol-1
O2(g)=ZnO(s) ΔH1=-351.1kJ·mol-1
Hg(l)+![]() O2(g)=HgO(s) ΔH2=-90.7kJ·mol-1
O2(g)=HgO(s) ΔH2=-90.7kJ·mol-1
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH3,其中ΔH3的值是( )
A.-441.8kJ·mol-1B.-254.6kJ·mol-1
C.-438.9kJ·mol-1D.-260.4kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A.1mol H2O2完全分解产生O2时,转移的电子数为2 NA
B.0. lmol 环氧乙烷(![]() ) 中含有的共价键数为0. 3 NA
) 中含有的共价键数为0. 3 NA
C.常温下,1L pH= l 的草酸 ( H2C2O4 ) 溶液中H+ 的数目为0. 1NA
D.1mol淀粉水解后产生的葡萄糖分子数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com