
| A. | 1.0mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 使酚酞变红的溶液:Na+、NH4+、SO42-、NO3- | |
| C. | 0.1mol•L-1AgNO3溶液:H+、K+、SO42-、Cl- | |
| D. | 使石蕊变红色的溶液:Mg2+、K+、SO42-、NO3- |
分析 A.硝酸钾在酸性条件下能够氧化亚铁离子;
B.使酚酞变红的溶液中存在大量氢氧根离子,铵根离子与氢氧根离子反应;
C.硝酸银与硫酸根离子、氯离子反应;
D.使石蕊变红色的溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应.
解答 解:A.KNO3、H+、Fe2+之间发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.使酚酞变红的溶液为碱性溶液,溶液中存在大量氢氧根离子,NH4+与氢氧根离子反应,在溶液中不能大量共存,故B错误;
C.AgNO3与SO42-、Cl-发生反应,在溶液中不能大量共存,故C错误;
D.使石蕊变红色的溶液为酸性溶液,溶液中存在大量氢离子,Mg2+、K+、SO42-、NO3-之间不发生反应,都不与氢离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查了离子共存的判断,题目难度中等,明确离子反应发生条件为解答关键,注意掌握离子共存的体积,如:发生复分解反应、发生氧化还原反应等,还要明确题中暗含条件的含义,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:填空题
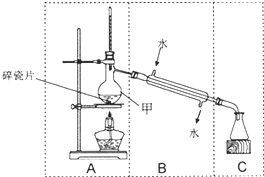 如图装置在中学化学实验中常用于物质的分离与提纯.
如图装置在中学化学实验中常用于物质的分离与提纯.| A.除去CO2气体中混有的少量HCl气体 |
| B.从硝酸钾和氯化钠的混合物中提纯得到硝酸钾 |
| C.用含有Fe3+的自来水获得少量纯净的水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
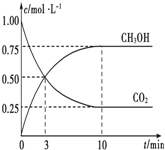 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1molCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是( )
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1molCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是( )| A. | 欲增大平衡状态时$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$的比值,可采用升高温度的方法 | |
| B. | 达到平衡状态时,CO2的平衡转化率为75% | |
| C. | 欲提高H2的平衡转化率只能加压减小反应容器的体积 | |
| D. | 从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溶解后过滤的方法除去CaCl2中的少量的ZnSO4 | |
| B. | 用萃取的方法分离NaCl溶液和汽油 | |
| C. | 用酒精萃取碘水中的碘 | |
| D. | 用蒸馏的方法除去水中的不挥发的杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X、Y位于第ⅠA族,则X、Y可能与氧元素形成原子个数比为1:1或2:1的化合物 | |
| B. | 若X、Y位于第三周期,则X、Y形成的化合物可能是离子化合物,也可能是共价化合物 | |
| C. | 若气态HnX的沸点高于HnY,则X、Y只能位于元素周期表的第ⅥA族 | |
| D. | 若X、Y位于周期表的同一周期,则最高价含氧酸的酸性可能是HnXOm>HaYOb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁发生析氢腐蚀时,0.56gFe反应 转移电子数为0.03NA | |
| B. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 1molH2O2分子中的非极性共价键 1NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
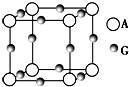 已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com