
 A、B、C、D、E为短周期元素,且原子序数依次递增.其中B元素形成化合物种类最多,A、E同主族.A与 E的质子数之和是B质子数的2倍,且E与D分别形成的最简单离子都含有10个电子.由以上元素组成的物质BD和C2具有相同的电子数.
A、B、C、D、E为短周期元素,且原子序数依次递增.其中B元素形成化合物种类最多,A、E同主族.A与 E的质子数之和是B质子数的2倍,且E与D分别形成的最简单离子都含有10个电子.由以上元素组成的物质BD和C2具有相同的电子数.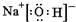 ,故答案为:
,故答案为: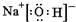 ;
;

科目:高中化学 来源: 题型:
| A、向某溶液中加入稀盐酸,产生能使石灰水变浑浊的气体,该溶液一定含有CO32- |
| B、向某溶液中滴加氯水后,滴加KSCN溶液,溶液呈红色,该溶液中一定含有Fe2+ |
| C、向某溶液中加入氯化钡溶液,产生不溶于稀盐酸白色沉淀,该溶液一定含有SO42- |
| D、往某溶液中加入NaOH,微热,产生能使湿润的红色石蕊试纸变蓝的气体,该溶液中一定含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
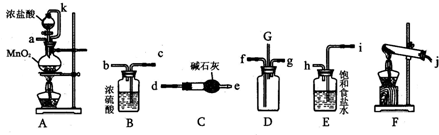
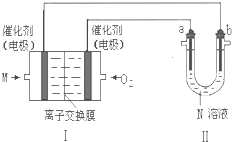
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:用试管取样品溶液2~3mL,再用滴管取 | 若出现血红色,则假设1成立; 若未出现血红色,则假设2或假设3成立. |
| 步骤2: | 结合步骤1的现象和结论, |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有A、B、C、D、E、F六种短周期元素,其元素特征信息如表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如表:| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
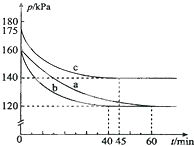 化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题:
化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com