
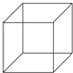
 立方烷的结构简式如图所示,每个顶点是一个碳原子.则:
立方烷的结构简式如图所示,每个顶点是一个碳原子.则:分析 ①由立方烷的结构可知,分子中含有8个C原子,利用H原子饱和C的四价结构,据此确定分子中H原子数目,写出分子式;
②分子中只有1中H原子,其一氯代物只有1种;
③烃的二氯代物的同分异构体可以采用固定1个氯原子移动另1个Cl的方法进行确定.
解答 解:①由立方烷的结构可知,分子中含有8个C原子,H原子饱和C的四价结构,故每个C原子连接1个H原子,分子中H原子数目为8,故立方烷的分子式为C8H8,
故答案为:C8H8;
②分子中只有1中H原子,其一氯代物只有1种,故答案为:1;
③立方烷的二氯代物中2个氯原子取代H原子位置有:一条棱上的C原子上的H原子、面对角线上的C原子上的H原子、体对角线上的C原子上的H原子,所以二氯代物的同分异构体有三种,
故答案为:3.
点评 本题考查烃的分子式的确定、烃的结构、同分异构体的书写等,难度中等,要求学生具有一定的空间想象的能力,掌握根据相对分子质量确定烃的分子式的方法.


科目:高中化学 来源: 题型:选择题
| A. | 刺激性气味的气体是氨气 | |
| B. | NH4CuSO3中硫元素被氧化 | |
| C. | 1 mol NH4CuSO3完全反应转移0.5 mol电子 | |
| D. | 反应中硫酸作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 未加入稀盐酸之前:c(HCN)>c(Na+)>c( CN-)>c(OH-)>c(H+) | |
| B. | 加稀盐酸后溶液中c(CN-)+c(HCN)=c(Na+) | |
| C. | pH=7时,溶液中:c( Na+)=c( CN-) | |
| D. | 加稀盐酸后H2O的电离程度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78% | B. | 22% | C. | 14% | D. | 13% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
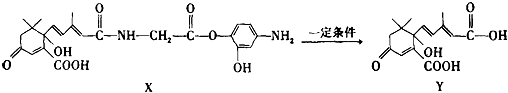
| A. | X可以发生氧化、取代、酯化、加聚、缩聚反应,并能与盐酸反应生成有机盐 | |
| B. | Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色 | |
| C. | 1mol X与足量NaOH溶液反应,最多消耗4mol NaOH | |
| D. | X结构中有2个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳-12原子表示为${\;}_{6}^{12}$C | |
| B. | 氮原子的L层电子的电子排布图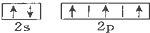 | |
| C. | 硫离子的核外电子排布式1s22s22p63s23p6 | |
| D. | NH4Cl的电子式为: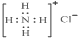 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第七周期0族 | B. | 第八周期第ⅠA族 | C. | 第六周期第ⅡA族 | D. | 第七周期第ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液的pH=a,将此溶液加水稀释后,溶液中各微粒浓度均减小 | |
| B. | 将浓度均为0.01 mol•L-1的CH3COOH和CH3COONa溶液等体积混合后,溶液中:c(CH3COOH)+c(CH3COO-)=0.01mol•L-1 | |
| C. | 将等体积,pH值均为3的醋酸和盐酸,分别加水稀释至amL和bmL,稀释后溶液的pH值均为5,则b>a=100 | |
| D. | 一定温度下,向0.1mol•L-1的醋酸溶液中加少量烧碱,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的比值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
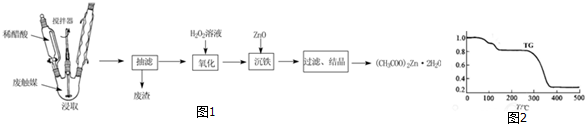
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com