
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.分析 I.(1)氯气氧化性强于硫单质,所以氯气能够与硫离子反应生成硫,自身被还原为氯离子;
Ⅱ.(2)氯气具有强氧化性,能将碘离子氧化为碘单质,碘遇淀粉试液变蓝色;氯气有毒,不能直接排空,可以用NaOH溶液稀释.
解答 解:I(1)氯气氧化性强于硫单质,所以氯气能够与硫离子反应生成硫,反应的离子方程式为:S2-+Cl2═S↓+2Cl-,
故答案为:S2-+Cl2═S↓+2Cl-;
Ⅱ.(2)KMnO4与浓盐酸反应生成氯气,氯气与淀粉碘化钾混合溶液反应生成碘单质,反应离子方程式为:
2I-+Cl2═I2+2Cl-,碘遇淀粉试液变蓝色,故C中溶液变为蓝色;过量的氯气会逸散到空气中,污染环境,可用NaOH溶液吸收,反应离子方程式为:2OH-+Cl2═Cl-+ClO-+H2O,
故答案为:2I-+Cl2═I2+2Cl-;变蓝;NaOH;2OH-+Cl2═Cl-+ClO-+H2O.
点评 本题考查实验方案设计,涉及非金属性强弱的比较、离子方程式书写等,明确物质的性质是解本题关键,同时考查学生灵活运用知识解答问题的能力,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
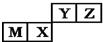
| A. | 原子半径:M>X>Y>Z | |
| B. | M的氯化物是弱电解质 | |
| C. | X的最简单气态氢化物的热稳定性比Z的小 | |
| D. | X的最高价氧化物不溶于任何酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 草酸稀溶液加水稀释,溶液中所有离子浓度均减小 | |
| B. | NaHC2O4溶液中有:2c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) | |
| C. | pH=3的草酸与pH=12的NaOH溶液混合至中性时,溶液中有:c(Na+)=c(HC2O4-)+2c(C2O42-) | |
| D. | 等浓度的草酸和碳酸相比,溶液中由水电离出来的c(H+)前者更多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaBr和NaI | B. | NaCl | C. | NaBr和NaCl | D. | NaCl和 I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2S溶液中:c(Na+)=c(HS-)+c(S2-) | |
| B. | 乙烯的燃烧热为akJ•mol-1(a>0),则乙烯燃烧的热化学方程式可表示为C2H4(g)+3O2(g)=2CO2(g)+2H2O(g)△H=-akJ•mol-1 | |
| C. | 钢铁发生吸氧腐蚀的正极反应式为O2+4e-+2H2O=4OH- | |
| D. | 从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
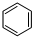 -CH3(g)+11H2△H=kJ•mol-1.
-CH3(g)+11H2△H=kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Lv位于周期表中第七周期第ⅥA族 | B. | Lv原子的次外层电子数为18 | ||
| C. | Lv为非金属元素 | D. | Lv为放射性元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com