
”¾ĢāÄæ”æÖŠ¹śµŚ¶ž»Æ¹¤Éč¼ĘŌŗĢį³ö£¬ÓĆ¼ä½Óµē»Æѧ·Ø¶Ō“óĘųĪŪČ¾ĪļNO½ųŠŠĪŽŗ¦»Æ“¦Ąķ£¬ĘäŌĄķŹ¾ŅāČēĶ¼£ØÖŹ×ÓĤŌŹŠķH+ŗĶH2OĶعż£©£¬ĻĀĮŠĻą¹ŲÅŠ¶ĻÕżČ·µÄŹĒ£Ø £©

A. ĪüŹÕĖžÖŠµÄ·“Ó¦ĪŖ2NO+2S2O32-+H2O=N2+4HSO3-
B. µē½ā³ŲÖŠÖŹ×Ó“Óµē¼«IĻņµē¼«¢ņ×÷¶ØĻņŅʶÆ
C. µē¼«IĪŖŅõ¼«£¬µē¼«·“Ó¦Ź½ĪŖ2H2O+2e-=2OH-+H2
D. Ć擦Ąķ1 mol NOµē½ā³ŲÖŹĮæ¼õÉŁ16g
”¾“š°ø”æA
”¾½āĪö”æA£®ĪüŹÕĖžÖŠĶØČėNOŗĶS2O42-·¢ÉśĄė×Ó·“Ó¦£¬Éś³ÉN2ŗĶHSO3-£¬ĖłŅŌ·“Ó¦·½³ĢŹ½ĪŖ£ŗ2NO+2S2O32-+H2O£½N2+4HSO3-£¬AÕżČ·£»B£®µē¼«IĪŖŅõ¼«£¬Ōņµē¼«¢ņĪŖŃō¼«£¬µē½ā³ŲÖŠŃōĄė×ÓĻņŅõ¼«ŅĘ¶Æ£¬ĖłŅŌµē½ā³ŲÖŠH+ĶعżÖŹ×ÓĤĻņµē¼«I“¦ŅĘ¶Æ£¬B“ķĪó£»C£®HSO3-ŌŚµē¼«IÉĻ×Ŗ»ÆĪŖS2O42-£¬¹ż³ĢÖŠSµÄ»ÆŗĻ¼Ū½µµĶ£¬µĆµ½µē×Ó·¢Éś»¹Ō·“Ó¦£¬Ōņµē¼«IĪŖŅõ¼«£¬µē¼«·“Ó¦ĪŖ£ŗ2HSO3-+2e-+2H+£½S2O42-+2H2O£¬C“ķĪó£»D£®µē¼«¢ņĪŖŃō¼«£¬H2OŌŚµē¼«¢ņÉĻ±»×Ŗ»ÆĪŖO2£¬·¢Éśµē¼«·“Ó¦£ŗ2H2O-4e-£½O2”ü+4H+£¬Ć擦Ąķ1 mol NO£¬Ōņ×ŖŅʵē×ÓŹżĪŖ1mol”Į2=2mol£¬øł¾Żµē×Ó×ŖŅĘŹŲŗć£¬Ōņ²śÉśO2µÄĪļÖŹµÄĮæĪŖ2mol”Į1/4=0.5mol£¬²śÉś2molHSO3-½ųČėµē½ā³Ų£¬0.5molO2ŅŻ³öµē½ā³Ų£¬1molS2O42-Į÷³öµē½ā³Ų£¬ĖłŅŌµē½ā³ŲÖŹĮæ¼õÉŁĪŖ2mol”Į81g/mol£0.5mol”Į32g/mol£1mol”Į128g/mol£½18g£¬D“ķĪ󣬓š°øŃ”A”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆÖŹĮæĻąĶ¬µÄĢśµ„ÖŹÓėĻĀĮŠĢõ¼žĻĀĻąĶ¬Ģå»żµÄĮņĖį·“Ó¦Ź±£¬Éś³ÉĒāĘųĖŁĀŹ×īæģµÄŹĒ£Ø £©
A.20”ęĢśĘ¬ 1mol/LĮņĖį
B.30”ęĢś·Ū 1mol/LĮņĖį
C.30”ęĢś·Ū 2mol/LĮņĖį
D.30”ęĢśĘ¬ 18mol/LĮņĖį
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ
£Ø1£©ŹĀŹµÖ¤Ć÷£¬ÄÜÉč¼Ę³ÉŌµē³ŲµÄ·“Ó¦Ķس£ŹĒ·ÅČČ·“Ó¦£¬ĻĀĮŠ»Æѧ·“Ó¦ŌŚĄķĀŪÉĻæÉŅŌÉč¼Ę³ÉŌµē³ŲµÄŹĒ ______”£
A.C£Øs£©+H2O£Øg£©ØTCO£Øg£©+H2£Øg£©”÷H£¾0
B.NaOH£Øaq£©+HCl£Øaq£©ØTNaCl£Øaq£©+H2O£Øl£©”÷H£¼0
C.2H2£Øg£©+O2£Øg£©ØT2H2O£Øl£©”÷H£¼0
£Ø2£©ŅŌKOHČÜŅŗĪŖµē½āÖŹČÜŅŗ£¬ŅĄ¾ŻĖłŃ”·“Ó¦Éč¼ĘŅ»øöŌµē³Ų£¬Ęäøŗ¼«µÄµē¼«·“Ó¦Ź½ĪŖ ”£
£Ø3£©µē½āŌĄķŌŚ»Æѧ¹¤ŅµÖŠÓŠ×Źć·ŗµÄÓ¦ÓĆ£®ĻÖ½«ÄćÉč¼ĘµÄŌµē³ŲĶعżµ¼ĻßÓėĶ¼ÖŠµē½ā³ŲĻąĮ¬£¬ĘäÖŠaĪŖµē½āŅŗ£¬XŗĶY¾łĪŖ¶čŠŌµē¼«£¬Ōņ£ŗ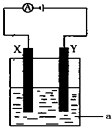
¢ŁČōaĪŖCuSO4ČÜŅŗ£¬Ōņµē½āŹ±µÄ»Æѧ·“Ó¦·½³ĢŹ½ĪŖ £®ĶصēŅ»¶ĪŹ±¼äŗó£¬ĻņĖłµĆČÜŅŗÖŠ¼ÓČė0.2molCuO·ŪÄ©£¬Ē”ŗĆ»Öø“µē½āĒ°µÄÅضČŗĶpH£¬Ōņµē½ā¹ż³ĢÖŠ×ŖŅʵĵē×ÓµÄĪļÖŹµÄĮæĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ Fe2O3£Øs£©+3CO£Øg£©2Fe£Øs£©+3CO2£Øg£© ŌŚ²»Ķ¬ĪĀ¶ČĻĀµÄĘ½ŗā³£ŹżČē±ķ£ŗ
ĪĀ¶Č/”ę | 1000 | 1150 | 1300 |
Ę½ŗā³£Źż | 42.9 | 50.7 | 64.0 |
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©øĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½ K= £¬”÷H 0£ØĢī”°£¾”±”¢”°£¼”±»ņ”°=”±£©”£
£Ø2£©ŌŚŅ»øöČŻ»żĪŖ10LµÄĆܱÕČŻĘ÷ÖŠ£¬1300”ꏱ¼ÓČė Fe”¢Fe2O3”¢CO”¢CO2ø÷1mol £¬ ·“Ó¦¾¹ż10min ŗó“ļµ½Ę½ŗā£®ĒóøĆŹ±¼ä·¶Ī§ÄŚ·“Ó¦µÄĘ½¾ł·“Ó¦ĖŁĀŹ v£ØCO2£©= £¬CO µÄĘ½ŗā×Ŗ»ÆĀŹĪŖ ”£
£Ø3£©ÓūĢįøߣØ2£©ÖŠCOµÄĘ½ŗā×Ŗ»ÆĀŹ£¬æɲÉČ”µÄ“ėŹ©ŹĒ ______”£
A.Ōö¼ÓFe2O3µÄĮæ
B.¼ÓČėŗĻŹŹµÄ“߻ƼĮ
C.ŅĘ³ö²æ·ÖCO2
D.Ģįøß·“Ó¦ĪĀ¶Č£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖH2£Øg£©+Cl2£Øg£©ØT2HCl£Øg£©”÷H=©184.6kJ/mol£¬Ōņ·“Ó¦HCl£Øg£©ØT ![]() H2£Øg£©+
H2£Øg£©+ ![]() Cl2£Øg£©µÄ”÷HĪŖ£Ø””””£©
Cl2£Øg£©µÄ”÷HĪŖ£Ø””””£©
A.+184.6kJ/mol
B.©92.3kJ/mol
C.©369.2kJ/mol
D.+92.3kJ/mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ298KŹ±£¬Ksp(NiS)£½1.0”Į10-21£¬Ksp(NiCO3)£½1.0”Į10-7 £»p(Ni)£½£lg c(Ni2+)£¬p(B)£½£lg c(S2-)»ņ£lg c(CO32-)”£ŌŚŗ¬ĪļÖŹµÄĮæÅضČĻąĶ¬µÄNa2SŗĶNa2CO3µÄ»ģŗĻČÜŅŗÖŠµĪ¼ÓNi(NO3)2ČÜŅŗ²śÉśĮ½ÖÖ³Įµķ£¬ČÜŅŗÖŠŃōĄė×Ó”¢ŅõĄė×ÓÅØ¶Č¹ŲĻµČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
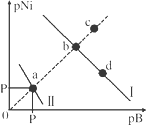
A. ³£ĪĀĻĀNiCO3µÄČܽā¶Č“óÓŚNiSµÄČܽā¶Č
B. Ļņdµć¶ŌÓ¦µÄČÜŅŗÖŠ¼ÓČė¶ŌÓ¦ŅõĄė×ÓµÄÄĘŃĪ£¬dµćĻņbµćŅʶÆ
C. ¶ŌÓŚĒśĻßI£¬ŌŚbµć¼ÓČČ£¬bµćĻņcµćŅʶÆ
D. PĪŖ3.5ĒŅ¶ŌÓ¦µÄŅõĄė×ÓŹĒCO32-
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĮ×¾«æó·ŪĖį½žŹ±·¢Éś·“Ó¦£ŗ2Ca5(PO4)3(OH)+3H2O+10H2SO4![]() 10CaSO4”¤0.5H2O+6H3PO4”£ÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ£Ø £©
10CaSO4”¤0.5H2O+6H3PO4”£ÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ£Ø £©
A. øĆ·“Ó¦ŹōÓŚŃõ»Æ»¹Ō·“Ó¦
B. ĮņĖįĖįŠŌ±ČĮ×ĖįĒæ
C. Ca5(PO4)3(OH)ŹĒŃĄÓŌÖŹµÄÖ÷ŅŖ³É·Ö£¬Ņ×ČÜÓŚĖ®
D. S”¢PĶ¬Ö÷×壬SµÄ·Ē½šŹōŠŌøüĒæ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚĢå»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ·¢Éś2SO2+O22SO3·“Ó¦£¬ĻÖæŲÖĘĻĀĮŠČżÖÖ²»Ķ¬µÄĢõ¼ž£ŗ¢ŁŌŚ400”ꏱ£¬10molSO2Óė5molO2·“Ó¦£»
¢ŚŌŚ400”ꏱ£¬20molSO2Óė5molO2·“Ó¦£»
¢ŪŌŚ300”ꏱ£¬10molSO2Óė5molO2·“Ó¦£»
£Ø1£©æŖŹ¼Ź±£¬»Æѧ·“Ó¦ĖŁĀŹæģĀżĖ³ŠņŹĒ£»
£Ø2£©Čō10minÄŚ²āµĆµŚ¢Ł×éµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ£ŗV£ØSO2£©=0.4mol/£ØLmin£©£¬ŌņV£ØO2£©= £¬ 10minŹ±£¬SO3ÅضČĪŖ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĮ×»ÆĀĮ”¢Į׻Ɗ攢Į×»ÆøĘÓėĖ®·“Ó¦²śÉśø߶¾µÄPH3ĘųĢå£ØČŪµćĪŖ-132”ę£¬»¹ŌŠŌĒ攢Ņ××ŌČ¼£©£¬æÉÓĆÓŚĮøŹ³Ń¬Õōɱ³ę”£ĪĄÉś°²Č«±ź×¼¹ę¶Ø£ŗµ±ĮøŹ³ÖŠĮ×»ÆĪļ£ØŅŌPH3¼Ę£©µÄŗ¬ĮæµĶÓŚ0.05mg”¤kg-1Ź±ĖćŗĻøń”£æÉÓĆŅŌĻĀ·½·Ø²ā¶ØĮøŹ³ÖŠ²ŠĮōµÄĮ×»ÆĪļŗ¬Įæ£ŗ

”¾²Ł×÷Į÷³Ģ”æ°²×°ĪüŹÕ×°ÖĆ”śPH3µÄ²śÉśÓėĪüŹÕ”ś×ŖŅĘKMnO4ĪüŹÕČÜŅŗ”śŃĒĮņĖįÄʱź×¼ČÜŅŗµĪ¶Ø”£
”¾ŹµŃé×°ÖĆ”æCÖŠŹ¢100 gŌĮø£¬DÖŠŹ¢ÓŠ 20.00 mL 1.12”Į10-4 mol L-1KMnO4ČÜ£ØH2SO4Ėį»Æ)”£
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ŅĒĘ÷CµÄĆū³ĘŹĒ_________£»ŌĮø×īŗĆĻČ“ņ³É·ŪÄ©£¬ĘäŌŅņŹĒ_____________”£
£Ø2£©Į×»ÆøĘÓėĖ®·“Ó¦ÓŠ»Æѧ·½³ĢŹ½ĪŖ_____________________________________£»¼ģ²éÕūĢ××°ÖĆĘųĆÜŠŌĮ¼ŗƵķ½·ØŹĒ_______________________________________”£
£Ø3£©AÖŠŹ¢×°KMnO4ČÜŅŗµÄ×÷ÓĆŹĒ³żČ„æÕĘųÖŠµÄ»¹ŌŠŌĘųĢ壻BÖŠŹ¢×°½¹ŠŌĆ»Ź³×ÓĖįµÄ¼īŠŌČÜŅŗ£¬Ęä×÷ÓĆŹĒĪüŹÕæÕĘųÖŠµÄO2£¬·ĄÖ¹___________£»ĶØČėæÕĘųµÄ×÷ÓĆŹĒ____________”£
£Ø4£©DÖŠPH3±»Ńõ»Æ³ÉĮ×Ėį£¬Ėł·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ_________________________”£
£Ø5£©°ŃDÖŠĪüŹÕŅŗ×ŖŅĘÖĮČŻĮæĘæÖŠ£¬¼ÓĖ®Ļ”ŹĶÖĮ250mL£¬Č”25.00mLӌ׶ŠĪĘæÖŠ£¬ÓĆ5.0”Į10-5mol L-1µÄNa2SO3±ź×¼ČÜŅŗµĪ¶ØŹ£ÓąµÄKMnO4ČÜŅŗ£¬ĻūŗıźNa2SO3×¼ČÜŅŗ11.00mL£¬ŌņøĆŌĮøÖŠĮ×»ÆĪļ£ØŅŌPH3¼Ę£©µÄŗ¬ĮæĪŖ______mg kg-1£¬øĆŌĮøÖŹĮæ________£ØĢī”°ŗĻøń”±»ņ”°²»ŗĻøń”±£©”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com